Am 25. August 2006 veröffentlichte Cell Kazutoshi Takahashi und Shinya Yamanakas Arbeit über die Induzierung von Pluripotenz in embryonalen und adulten Fibroblasten. Die hoffnungsvollen Erwartungen auf eine baldige therapeutische Nutzung dieser Technik, z.B. für neurodegenerative Erkrankungen, konnten sich zwar bis jetzt noch nicht bestätigen, doch sind diese induzierten pluripotenten Stammzellen trotzdessen aus der Pharmaforschung und vielen Laboren nicht mehr wegzudenken.
Die Stammzellkontroverse
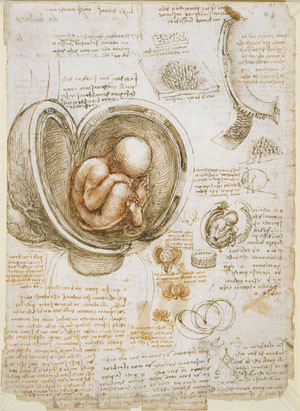
Die Entwicklungsbiologie im Allgemeinen und folglich auch die Stammzellforschung war schon immer ein kontroverses Thema, ganz besonders wenn das Interesse des Wissenschaftlers auf den Menschen fiel. Bis in das späte Mittelalter hinein stieß das Sezieren von Toten in weiten Teilen der Bevölkerung aus religiösem und moralischem Eifer auf strikte Ablehnung und häufig war es sogar gänzlich verboten. Nach und nach fand das Sezieren aber auch an europäischen Universitäten Verbreitung. Die erste öffentliche Leichensektion im christlichen Abendland wird auf 1315 datiert. Doch das mit dieser Tätigkeit verbundene Stigma verblieb. Die Ärzte des Mittelalters mussten daher lange auf die oft ungenauen oder fehlerhaften anatomischen Darstellungen und Beschreibungen in den Werken der antiken Gelehrten wie Galen und Celsus vertrauen. Über die Entwicklungsphasen oder gar die physiologischen Prozesse des Kindes während der Schwangerschaft war folglich kaum etwas bekannt. Gleiches galt für all die anderen Besonderheiten der menschlichen Anatomie, die sich durch Obduktionen von Tieren nicht erschließen lassen. Diese Stagnation des medizinischen Fortschritts endete erst mit Beginn der Renaissance und Leonardo da Vinci war Anfang des 16. Jahrhunderts einer der ersten, der anatomisch korrekte Zeichnungen eines Fötus in der Gebärmutter anfertigte, mehr als 1300 Jahre nach dem Tod von Galen (siehe Abbildung).
Die Kontroverse rund um die anatomische Forschung und die Embryologie im Besonderen hat sich natürlich in den letzten 700 Jahren gewandelt: Von einem generellen Tabu der Entweihung des menschlichen Körpers hin zu der Frage, wann menschliches Leben tatsächlich anfängt und welchen Schutz wir diesem Leben zugestehen müssen. Das übergreifende Thema der Debatte, namentlich die Abwägung von Menschenwürde in all ihren Auslegungen mit den Vorteilen wissenschaftlichen Fortschritts und der Befriedigung unserer Neugierde, blieb aber interessanterweise unverändert und ist besonders für die Stammzellforschung bedeutsam. Auch mit der heutigen Technologie müssen Forscher für die Herstellung humaner embryonaler Stammzellen (ES-Zellen) einen menschlichen Embryo zerstören. Ein ethisches Dilemma für viele. Die Arbeit eines ganzen Forschungszweigs der Lebenswissenschaften ist daher in vielen Staaten der Welt Thema öffentlicher Debatten oder sogar illegal. Und während oben genannte Maximen in Parlamenten, Ethikkommissionen und unter Wissenschaftlern diskutiert werden, scheint ein allgemein anerkannter Kompromiss noch immer in weiter Ferne.
Der lange Weg zur Pluripotenz
Die Protagonisten dieses Science History Kapitels haben wohl den größten Beitrag zu einer möglichen Lösung dieses Streitthemas getan, indem sie eine Methode entwickelt haben, mit der differenzierte somatische Zellen zu pluripotenten Zellen mit ES-ähnlichen Eigenschaften umprogrammiert werden können. Shinya Yamanaka begann seine akademische Laufbahn an der medizinischen Fakultät der Universität Kobe. nach seiner Doktorarbeit über die Funktion von Platelet Activating Factor (PAF) und Thromboxan A2 in der Blutdruckregulation, zog es Yamanaka zum Gladstone Institute of Cardiovascular Disease in San Francisco, um dort die damals neue Knockout-Maus-Technik zu erlernen.
Im Rahmen seiner Forschung über die kanzerogenen Eigenschaften von APOBEC1, entdeckte er ein neues Zielprotein von APOBEC1, welches er sehr passend Novel APOBEC1 Target #1 (NAT1) taufte. Bei seinen wenig erfolgreichen Versuchen NAT1-/- Mäuse herzustellen, stellte sich heraus, dass NAT1 ein wichtiger Faktor der frühen Embryonalentwicklung und essentiell für die Erhaltung der Pluripotenz der murinen ES-Zellen ist. Zur etwa gleichen Zeit veröffentlichte James Thomson sein Paper über die Kultivierung humaner embryonaler Stammzellen aus Blastozyten und angeregt durch diese bahnbrechende Arbeit konzentrierte sich Yamanaka von nun an vollends auf die Stammzellforschung. Er bekam eine Professur am Nara Institut für Naturwissenschaft und Technologie (NAIST) und konnte dort erstmals sein eigenes Labor organisieren. Konfrontiert mit dem Verbot der Herstellung humaner ES-Zellen in Japan und der Konkurrenz durch andere Arbeitsgruppen, die damals primär an der gezielten Steuerung der Stammzelldifferenzierung forschten, entschied sich Yamanaka für den umgekehrten Ansatz: der Herstellung pluripotenter Zellen aus bereits differenzierten somatischen Zellen. Frühere Zellfusionsxperimente von ES-Zellen mit somatischen Zellen hatten bereits gezeigt, dass dies prinzipiell möglich ist und dass in ES-Zellen exprimierte Proteine Pluripotenz induzieren können. Yamanaka und seine Mitarbeiter verbrachten folglich die nächsten Jahre damit, eben diese Faktoren zu identifizieren und in eine Genbank einzupflegen. Zu diesem Zweck suchten Sie nach Proteinen, die spezifisch in murinen Embryonen exprimiert werden. Eines dieser ES-Zell-assoziierten Transkripte (ECATs) war Fbox15, dessen Knockout keinen nennenswerten Phänotyp aufwies. Dieses anfänglich enttäuschende Ergebnis war aber bald von Nutzen, da sich die Fbox15-/- Zellen als wertvolles Assaysystem für pluripotente Zellen herausstellte. Durch Einführung eines Neomycin-Resistenzgens in den Fbox15 Lokus erhielten sie ein Zellsystem, in dem differenzierte Zellen G418 sensitiv und pluripotente Zellen G418 resistent sind. Sie transfizierten ihre Fbox15-/- embryonalen Mausfibroblasten (MEFs) in der Folge mit den 24 vielversprechendsten ECATs, doch keines dieser Genes war für sich in der Lage Pluripotenz zu induzieren. Yamanaka und Kazutoshi Takahashi fanden aber letztendlich pluripotente Kolonien nachdem sie die MEFs mit allen 24 Genen transfizierten. Durch das Weglassen einzelner Faktoren konnten sie schließlich die vier essenziellen Faktoren identifizieren: Oct3/4, Sox2, c-Myc and Klf. Die auf diese Weise generierten induzierten pluripotenten Stammzellen (iPSCs) verhalten sich in vielerlei Hinsicht wie normale ES-Zellen und können zu Zellen aller somatischer Gewebe differenziert werden. Takahashi und Yamanaka publizierten ihre Methode am 25. August 2006 und Yamanaka wurde in Anerkennung dieser Entdeckung 2012 der Nobelpreis für Physiologie und Medizin verliehen.
Momentane und zukünftige Anwendungen von iPSCs
Die Methode zur Umprogrammierung somatischer Zellen zu ES-Zell-ähnlichen pluripotenten Zellen war in seinen Auswirkungen revolutionär. Stammzellforscher haben jetzt eine Alternative zu den kontroversen embryonalen Stammzellen, auch wenn diese weiterhin als Goldstandard gelten. Zellbasierte Assays zur Wirkstoffanalyse können nun mit nahezu authentischen aus iPSCs differenzierten Zellen arbeiten. Zuvor war man für diese Methode zumeist auf Krebszelllinien angewiesen, die sich in der Regel enorm von nativen Zellen unterscheiden. Mit der iPSC Technologie lassen sich zudem patientenspezifische Stammzellen generieren, die dann theoretisch in Stammzelltherapien eingesetzt werden können, ohne dass das Risiko von Abstoßungsreaktionen besteht. Von der therapeutischen Anwendung induzierter pluripotenter Stammzellen sind wir allerdings noch etwas entfernt. Der Hauptgrund hierfür ist die Eigenschaft von iPSCs Tumore zu bilden. Alternative Ansätze zur iPSC Herstellung, die beispielsweise auf das Onkogen c-Myc verzichten oder die Zellen nur transient oder gar nicht transfizieren, und so zumindest eine Reduktion des Tumorrisikos versprechen, sind für die therapeutische Anwendung ebenfalls noch nicht weit genug entwickelt. Wir sind aber davon überzeugt, dass die Wissenschaft auch hier Lösung finden wird.
Bildnachweis
Leonardo da Vincis Darstellung eines Fötus in der Gebärmutter, gezeichnet zwischen 1510 und 1513.