Artikel aus der ersten Ausgabe der Biomol Insight: Immun-Checkpoints & Immuntherapie-Forschung.
Ziel von Krebsimmuntherapien ist die Mobilisierung der zahlreichen Komponenten des Immunsystems im Kampf gegen entartete Tumorzellen. Genauer, die Immuntherapie maximiert die Effizienz der durch dendritische Zellen und Lymphozyten vermittelten Antigenpräsentation und –erkennung. Im Idealfall erreicht dieser Ansatz eine selektivere Tötung der Krebszellen, als dies mit anderen Therapieansätzen wie beispielsweise der Chemotherapie möglich wäre. Die Immun-Checkpoint Therapie ist eine Variante der Krebsimmuntherapie, die auf die gezielte Aktivierung von T-Zellen (TCs) abzielt. Aktivierte T-Lymphozyten proliferieren, produzieren diverse Zytokine und können ihre Zielzellen mit hoher Selektivität abtöten. Die Aktivierung erfolgt über die Bindung des T-Zell-Rezeptors (TCR) an den Antigen-beladenen AG/MHC Komplex (Major Histocompatibility Complex) professioneller Antigen präsentierender Zellen (APCs). Die Selektivität und Stärke der Aktivierung wird hierbei durch den Einfluss co-stimulierender und inhibitorischer Faktoren an den sogenannten Immun-Checkpoints reguliert.
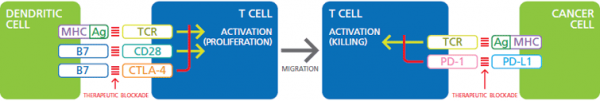
Die Immun-Checkpoint Therapie nutzt die Manipulation der regulatorischen Checkpoints, um die T-Zell Antwort gegen Tumoren zu verstärken. Am besten verstanden sind zurzeit die Interaktionen der Co-Rezeptoren, welche die TCR-vermittelte TC-Aktivierung supprimieren (Siehe Abbildung). Ein Beispiel hierfür ist CTLA-4 (CTL-Associated Protein-4), ein auf T-Zellen exprimierter inhibitorischer Co-Rezeptor, der, wenn gleichzeitig mit dem TCR stimuliert, die T-Zell Aktivierung blockiert. CTLA-4-spezifische Antikörper können also durch Blockade der CTLA-4 Signalgebung die T-Zell-Antwort gegen den Tumor verstärken. Dieser Ansatz konnte bereits mit begrenztem aber messbarem Erfolg bei der Behandlung von Krebspatienten eingesetzt werden, jedoch reagierten die Patienten nur langsam und der Effekt war nicht immer selektiv gegen Tumorzellen.1,2 Ein großes Hindernis ist hierbei, dass die CTLA-4 Blockade früh in der T-Zell Entwicklung erfolgen muss, während die APCs die T-Zellen zur Proliferation anregen. Ein besserer Ansatz wäre es anzugreifen, wenn sich T- und Tumorzelle treffen und der TCR das zytotoxische Programm des T-Lymphozyten initiiert.
PD-1 (Programmed Death-1) ist ein auf Lymphozyten exprimierter Rezeptor, der nach Bindung seiner Liganden PD-L1 oder PD-L2 die TCR-vermittelte Aktivierung der T-Zellen inhibiert und so ihre zytotoxische Aktivität reduziert. Die Zellen einiger Tumore machen sich dies zu Nutze, indem sie PD-L1 produzieren, was erwartungsgemäß mit einer deutlich schlechteren Prognose für den Patienten einher geht. Im Verlauf der letzten Jahre wurden daher diverse Antikörper entwickelt, die die PD-1 – PD-L1 Interaktion blockieren und die Ergebnisse der klinischen Studien sind vielversprechend. 3,4

Abbildung. Co-Stimulation von TCR und CD28 durch Ag/MHC und B7 dentritischer Zellen aktiviert die Proliferation und Migration von T-Zellen. Die negative Regulation von TCR durch den B7:CTLA-4 Signalweg kann durch therapeutische Antikörper blockiert werden. Ähnlich funktioniert die Signalübertragung von Ag/MHC über TCR bei Krebszellen, dass zum Abtöten der Krebszellen führt. Die Blockierung der negativen Regulation durch PD-L1:PD-1 ist ein weiteres Ziel der Immuntherapie.
Die Beispiele der Checkpoint-Rezeptoren CTLA-4 und PD-1 beweisen die prinzipielle Durchführbarkeit dieser Art von Immuntherapie. Natürlich funktioniert die Blockade von PD-1 nur dann, wenn der Tumor PD-1 Liganden produziert. Aus diesem Grund werden stetig weitere inhibitorische Checkpoint-Rezeptoren identifiziert (siehe Tabelle) wobei auch Ansätze, die mit aktivierenden Rezeptoren arbeiten erwägt werden.1,5
Die Immunsupprimierung kann natürlich auch durch die Beeinflussung wichtiger Stoffwechselprozesse, zum Beispiel der Indolamin-Deoxygenasen (IDOs), Arginase oder über lösliche Faktoren wie TGF-β und Adenosin erfolgen.6 Diese Signalwege können zurzeit am besten mittels Inhibitormolekülen beeinflusst werden. Eine Kombinationstherapie mit Antikörpern und Inhibitoren wird voraussichtlich ein zentrales Element der Behandlung von Krebsleiden werden.
Liganden-Rezeptor Paare mit Relevanz für die Immun-Checkpoint Therapie
| Antigenpräsentierende Zelle |
T-Zelle | ||
| Ligand/Rezeptor | Auch bekannt als | Ligand/Rezeptor | Auch bekannt als |
| CD40 | TNFRSF5 | CD40L | TNFSF5, CD154 |
| TL1A | TNFSF15 | DR3 | TNFRSF25 |
| GITRL | TNFSF18 | GITR | TNFRSF18, CD357 |
| 4-1BBL | TNFSF9, CD137L | 4-1BB | TNFRSF9, CD137 |
| OX40L | TNFSF4, CD252 | OX40 | TNFRSF4, CD134 |
| CD70 | TNFSF7, CD27L | CD27 | TNFRSF7 |
| HHLA2 | B7-H7 | TMIGD2 | TNFRSF14 |
| ICOSL | B7-H2, CD275 | ICOS | CD278 |
| CD80 | B7-1 | CD28 | |
| CD86 | B7-2 | ||
| MHC class I, II | KIR | ||
| TCR | |||
| LAG3 | CD223 | ||
| CD80 | B7-1 | CTLA-4 | CD152 |
| CD86 | B7-2 | ||
| CD80 | B7-1 | PD-L1 | B7-H1, CD274 |
| PD-L1 | B7-H1, CD274 | PD-1 | CD279 |
| PD-L2 | B7-DC, CD273 | ||
| PD-L1 | B7-H1, CD274 | CD80 | B7-1 |
| VISTA (2) | B7-H5, SISP1 | - | |
| BTNL2 (2) | - | ||
| B7-H3 | CD276 | - | |
| B7-H4 | VTCN1 | - | |
| CD48 | BCM1 | - | |
| Phosphatidylserine | TIM-3 (2) | HAVcr-2, CD366 | |
| Gal9 | LGALS9 | ||
| HVEM | TNFRSF14, CD270 | BTLA | CD272 |
| CD160 | |||
| LIGHT | TNFSF14, HVEML, CD258 | ||
Tabelle. Liganden-Rezeptor-Paare mit Relevanz für die Immun-Checkpoint Therapie. Paare, die hemmende Signale übertragen sind rot unterlegt, während co-stimulatorische Paare grün schattiert sind. (Adaptiert von Mahoney, K.M., Rennert, P.D., Freeman, G.J. Combination cancer immunotherapy and new immunomodulatory targets. Nat. Rev. Drug Discov. 14(8), 561-584 (2015))
Referenzen
- Pardoll, D.M. The blockade of immune checkpoints in cancer immunotherapy. Nat. Rev. Cancer 12(4), 252-264 (2012).
- Farkona, S., Diamandis, E.P., and Blasutig, I.M. Cancer immunotherapy: The beginning of the end of cancer? BMC Med. 14(1), (2016).
- Chen, D.S. and Mellman, I. Oncology meets immunology: The cancer-immunity cycle. Immunity 39(1), 1-10 (2013).
- Norde, W.J., Hobo, W., van der Voort, R., et al. Coinhibitory molecules in hematologic malignancies: Targets for therapeutic intervention. Blood 120(4), 728-736 (2016).
- Collin, M. Immune checkpoint inhibitors: A patent review (2010-2015). Expert Opin. Ther. Pat. 26(5), 555-564 (2016).
- Antonia, S.J., Vansteenkiste, J.F., and Moon, E. Immunotherapy: Beyond anti-PD-1 and anti-PD-L1 therapies. Am. Soc. Clin. Oncol. Educ. Book 35, e450-e458 (2016).






![CD152 [CTLA-4] -muIg Fusion Protein, (human), Biotin conjugated CD152 [CTLA-4] -muIg Fusion Protein, (human), Biotin conjugated](https://www.biomol.com/media/image/ae/57/3b/ANC-501-030_200x200.png)
