Cookie-Einstellungen
Diese Website benutzt Cookies, die für den technischen Betrieb der Website erforderlich sind und stets gesetzt werden. Andere Cookies, die den Komfort bei Benutzung dieser Website erhöhen, der Direktwerbung dienen oder die Interaktion mit anderen Websites und sozialen Netzwerken vereinfachen sollen, werden nur mit Ihrer Zustimmung gesetzt.
Konfiguration
Technisch erforderlich
Diese Cookies sind für die Grundfunktionen des Shops notwendig.
"Alle Cookies ablehnen" Cookie
"Alle Cookies annehmen" Cookie
Ausgewählter Shop
CSRF-Token
Cookie-Einstellungen
FACT-Finder Tracking
Individuelle Preise
Kundenspezifisches Caching
Session
Währungswechsel
Komfortfunktionen
Diese Cookies werden genutzt um das Einkaufserlebnis noch ansprechender zu gestalten, beispielsweise für die Wiedererkennung des Besuchers.
Facebook-Seite in der rechten Blog - Sidebar anzeigen
Merkzettel
Statistik & Tracking
Endgeräteerkennung
Kauf- und Surfverhalten mit Google Tag Manager
Partnerprogramm
| Artikelnummer | Größe | Datenblatt | Manual | SDB | Lieferzeit | Menge | Preis |
|---|---|---|---|---|---|---|---|
| A300-501A-T | 10 µl (10 µg) | - |
2 - 8 Werktage* |
164,00 €
|
|||
| A300-501A | 100 µl (100 µg) | - |
2 - 8 Werktage* |
588,00 €
|
Bei Fragen nutzen Sie gerne unser Kontaktformular.
Bestellen Sie auch per E-Mail: info@biomol.com
Größere Menge gewünscht? Bulk-Anfrage
Bestellen Sie auch per E-Mail: info@biomol.com
Größere Menge gewünscht? Bulk-Anfrage
Protein function: Repressor of translation initiation that regulates EIF4E activity by preventing... mehr
Produktinformationen "Anti-4EBP1"
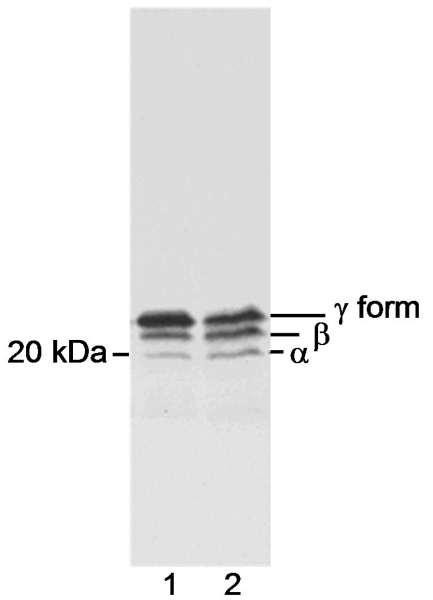
Protein function: Repressor of translation initiation that regulates EIF4E activity by preventing its assembly into the eIF4F complex: hypophosphorylated form competes with EIF4G1/EIF4G3 and strongly binds to EIF4E, leading to repress translation. In contrast, hyperphosphorylated form dissociates from EIF4E, allowing interaction between EIF4G1/EIF4G3 and EIF4E, leading to initiation of translation. Mediates the regulation of protein translation by hormones, growth factors and other stimuli that signal through the MAP kinase and mTORC1 pathways. [The UniProt Consortium]
| Schlagworte: | Anti-4E-BP1, Anti-PHAS-I, Anti-EIF4EBP1, Anti-eIF4E-binding protein 1, Anti-Eukaryotic translation initiation factor 4E-binding protein 1, Anti-Phosphorylated heat- and acid-stable protein regulated by insulin 1 |
| Hersteller: | Bethyl Laboratories |
| Hersteller-Nr: | A300-501A |
Eigenschaften
| Anwendung: | WB, IHC |
| Antikörper-Typ: | Polyclonal |
| Konjugat: | No |
| Wirt: | Rabbit |
| Spezies-Reaktivität: | human (Erwartet: mouse, rat) |
| Immunogen: | synthetic peptide. The epitope recognized by A300-501A-T maps to a region between residue 75 and the C-terminus (residue 118) of human eukaryotic translation initiation factor 4E binding protein 1 using the numbering given in entry NP_004086.1 (GeneID 1978). |
| Format: | Antigen Affinity Purified |
Datenbank Information
| KEGG ID : | K07205 | Passende Produkte |
| UniProt ID : | Q13541 | Passende Produkte |
| Gene ID | GeneID 1978 | Passende Produkte |
Handhabung & Sicherheit
| Lagerung: | +4°C |
| Versand: | +4°C (International: +4°C) |
Achtung
Nur für Forschungszwecke und Laboruntersuchungen: Nicht für die Anwendung im oder am Menschen!
Nur für Forschungszwecke und Laboruntersuchungen: Nicht für die Anwendung im oder am Menschen!
Hier folgen Informationen zur Produktreferenz.
mehr
Hier kriegen Sie ein Zertifikat
Loggen Sie sich ein oder registrieren Sie sich, um Analysenzertifikate anzufordern.
Bewertungen lesen, schreiben und diskutieren... mehr
Kundenbewertungen für "Anti-4EBP1"
Bewertung schreiben
Loggen Sie sich ein oder registrieren Sie sich, um eine Produktbewertung abzugeben.
Zuletzt angesehen