Geschrieben von Dr. Jane Naberhuis
Für die Entwicklung von neuen Immuntherapien ist es unumgänglich, die Tumormikroumgebung zu erforschen. Immunhistochemie ist eine vielseitig einsetzbare Technik, um die Expression, Verteilung und Aktivierung von Proteinen in situ zu untersuchen. Zur Erkennung von Antigenen werden spezifische Antikörper auf dünnen Querschnitten aus schockgefrorenem oder Formaldehyd-fixiertem, paraffineingebettetem Gewebe eingesetzt. Die Visualisierung des Antigens wird durch enzymatische Reaktionen, die am Ort der Antikörper-Antigen-Bindung zur Präzipitation von Farbstoff führen, oder durch fluoreszierende Reporter ermöglicht. Fluoreszierende Reporter können entweder direkt an den primären Antikörper konjugiert werden (direkte Immunfluoreszenz) oder an einen sekundären Antikörper, der den Spezies-spezifischen primären Antikörper erkennt (indirekte Immunfluoreszenz). Die letzte Variante ist die häufiger angewandte Methode, da sie noch bei sehr geringen Antigen-Mengen Signale liefert.
In der Vergangenheit wurde diese Technik für jeden Immunmarker einzeln angewandt. In letzter Zeit hat sich die molekulare Histopathologie von Einzel-Marker Immunhistochemie hin zu Multiplex-Marker-Detektion entwickelt. Multiplex Immunhistochemie, auch mehrfach Immunlabeling oder Multiplex Immunostaining genannt, kann die aus einer einzelnen Probe gewonnene Datenmenge maximieren. Dies ist besonders wichtig in Fällen, bei denen die Probenmenge begrenzt ist, wie zum Beispiel bei einer Tumorbiopsie. Im Gegensatz zur Next Generation Sequenzierung oder Massenspektrometrie kann bei der Multiplex Immunhistochemie sowohl die räumliche Anordnung von Proteinen als auch Protein-Interaktionen und Co-Lokalisation untersucht werden.
Chromogene Nachweise sind zwar prinzipiell mit Multiplex Immunhistochemie kompatibel, aber indirekte Labeling-Techniken mit Tyramid-basierter Fluoreszenz haben mehrere Vorteile. Durch die Ablagerung von Fluorophor-konjugiertem Tyramid an der Antigen-Bindungsstelle wird das Signal amplifiziert. Tyramid Signal Amplifikation (TSA) ermöglicht die Erkennung von sehr seltenen Targets in einer Probe und verbessert das Fluoreszenz-Signal. Außerdem ist wichtig, dass TSA auch die Verwendung von nicht-markierten primären Antikörpern erlaubt, mit der Flexibilität, mehrere Antikörper aus derselben Spezies einsetzen zu können.
Ein weiterer nicht unwichtiger Vorteil des Tyramid-basierten Fluoreszenz-Nachweises liegt in der Beständigkeit der Tyramid-Antigen Bindung, die durch die kovalente Bindung von Tyrosinresten am oder in der Nähe des Antigens stattfindet. Diese Beständigkeit erlaubt die Entfernung von Antikörpern mithilfe von Hitze, wobei das Fluoreszenzsignal des Antigens bestehen bleibt. Mit dieser Methode können verschiedene Antikörper aus der gleichen Wirtsspezies nacheinander angewendet werden ohne die sonst zu erwartende Kreuzreaktionen. Wenn zusätzlich unterschiedliche, nicht-überlappende Anregungs- und Emissionswellenlängen gewählt werden, ist es ein leichtes, verschiedene Zielproteine gleichzeitig zu visualisieren. Multispektral-Aufnahmen erlauben die grafische Isolierung von Fluorophoren mit partiell überlappenden Spektren und die Reduzierung von Gewebeautofluoreszenz.
Neuste Fortschritte in der Multiplex Immunhistochemie und der Multispektralbildgebung ermöglichen die genaue und gleichzeitige Analyse mehrerer Gewebsmarker. Beispielsweise kann die Analyse von Proliferations- und Autophagiemarkern im Darmgewebe bei der genauen Einschätzung des Epithel-Turnovers helfen. In der klinischen Anwendung kann die Aufklärung der Tumormikroumgebung und die Auswahl von zielgerichteten Therapien durch das Lokalisieren und die Untersuchung von Immuncheckpoint-Proteinen verbessert werden. Die Anwendungen von Multiplex Immunhistochemie sind vielseitig und beinhalten klinische, translationale und Grundlagenforschung.

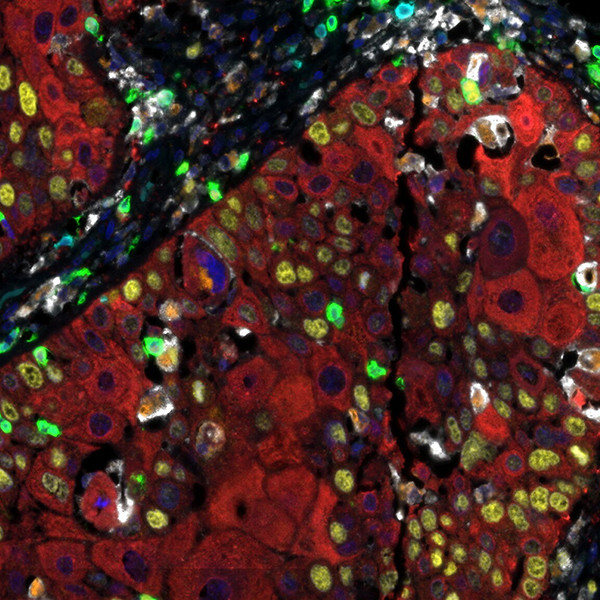
Nachweis von humanem CD3 (türkis), CD8 (grün), CD68 (orange), CK (rot), Ki67 (gelb) und PD-L1 (weiß) in FFPE HNSCC mit IHC-IF. Rabbit anti-CD3e recombinant monoclonal [BL-298-5D12], rabbit anti-CD8a recombinant monoclonal [BLR044F], mouse anti-CD68 monoclonal [KP-1], mouse anti-cytokeratin monoclonal [AE1/AE3], rabbit anti-Ki67 monoclonal [BLR021E] und rabbit anti-PD-L1 recombinant monoclonal [BLR020E]. Sekundärantikörper: HRP-conjugated goat anti-rabbit IgG und HRP-conjugated goat anti-mouse IgG. Substrat: Opal™ 480, 520, 570, 620, 690 und 780. Gegenfärbung: DAPI (blau).

Nachweis von humanem CD3 (gelb), CD8 (rot), und CD20 (grün) in FFPE Mundel-Gewebe mit IHC-IF. Rabbit anti-CD3e recombinant monoclonal [BL-298-5D12], rabbit anti-CD8a recombinant monoclonal [BLR044F], mouse anti-CD20 monoclonal [L26]. Sekundärantikörper: HRP-conjugated goat antirabbit IgG und HRP-conjugated goat anti-mouse IgG. Substrat: Opal™ 520, 620, und 690. Gegenfärbung: DAPI (blau).

Nachweis von humanem CD3 (gelb), CD20 (grün), und CD68 (rot) in FFPE Lungenkrebs-Gewebe mit IHC-IF. Rabbit anti-CD3e recombinant monoclonal [BL-298-5D12], mouse anti-CD20 monoclonal [L26], und mouse anti-CD68 monoclonal [KP-1]. Sekundärantikörper: HRP-conjugated goat antirabbit IgG und HRP-conjugated goat anti-mouse IgG. Substrat: Opal™ 520, 620, und 690. Gegenfärbung: DAPI (blau).
Erforderliche Reagenzien
Vorteile der Fluoreszenz Multiplex Immunhistochemie durch Einsatz von TSA
Die Fluoreszenz Multiplex Immunhistochemie (mIHC) mit Tyramid-Signalamplifikation (TSA) hat mehrere Vorteile gegenüber der one-color oder auch der traditionellen mIHC. Die unten aufgeführten Vorzüge zeigen, was die mIHC mit TSA zu einer leistungsstarken Technik für die Visualisierung von mehreren interessanten Zielstrukturen macht:
- Visualisierung von mehreren Zielstrukturen innerhalb eines einzigen Gewebeschnitts
Dies ist entscheidend für Experimente, in denen die Probenmenge begrenzt ist, wie z.B. bei Tumorbiopsien oder anderen klinischen Proben. mIHC ermöglicht die Erfassung der maximalen Datenmenge aus einer einzigen Probe. - Untersuchung der räumlichen Anordnung der Zielstrukturen
Die Visualisierung mehrerer Targets innerhalb eines einzigen Gewebeschnitts ermöglicht die Untersuchung der räumlichen Anordnung der Strukturen zueinander. Das führt zu einem besseren Verständnis der Proteininteraktion oder der Co-Lokalisierung innerhalb der konservierten Gewebearchitektur. Diese Art der Untersuchung ist mit anderen Techniken wie der Polymerase-Kettenreaktion, der Massenspektrometrie oder der Next-Generation-Sequenzierung nicht möglich. - Weitere dynamische und lineare Messbereiche
Im Vergleich zur chromogenen Detektion bietet die Fluorophor-Detektion einen breiteren dynamischen und linearen Messbereich, wodurch es einfacher wird, auf demselben Objektträger sowohl Targets mit hoher als auch mit geringer Häufigkeit zu visualisieren. Die Verwendung von TSA ermöglicht zudem die Signalverstärkung von Targets mit geringer Häufigkeit durch eine Verstärkung des antigen-assoziierten Fluoreszenzsignals. - Vereinfachtes Panel-Design
Das dauerhafte Bestehen der kovalenten Tyramid-Tyrosin-Bindung erleichtert die hitzevermittelte Entfernung von primären/sekundären Antikörperpaaren ohne Unterbrechung des Fluoreszenzsignals. Dies bedeutet, dass jeder für IHC validierte Primärantikörper, unabhängig von der Wirtsspezies, für jede Zielstruktur verwendet werden kann, solange ein spezifischer Sekundärantikörper verwendet wird. - Verwendung von DAPI als Gegenfärbung
Die Gegenfärbung der DNA mit DAPI ist dem Hämatoxylin vorzuziehen, da Hämatoxylin bei der chromogenen Färbung durch andere Targets verdeckt werden kann. - Spektrale Entmischung
Die spektrale Entmischung stellt sicher, dass die Signale jeder einzelnen Zielstruktur von denen der anderen Zielstrukturen unterschieden werden kann. Sie ermöglicht auch die Subtraktion des Signals, das durch die Autofluoreszenz des Gewebes entsteht. - Rationalisierte Quantifizierung
Die objektive Bestimmung des Expressionslevels mehrerer Targets kann durch den Einsatz einer geeigneten Bildgebungs-Plattform und Software vereinheitlicht werden. Da die Gewebearchitektur in der mIHC erhalten bleibt, kann die Visualisierung von Gewebe-Referenzpunkten ebenfalls zur genauen Quantifizierung beitragen.
Alles zusammengenommen stellen diese Merkmale der fluoreszierenden mIHC mit TSA einen robusten Ansatz für die Analyse von Gewebe dar. Eine solche Analyse ermöglicht eine Vielzahl von Anwendungen, wie z.B. die Charakterisierung von molekularen Signalwegen, Protein-Protein-Wechselwirkungen, das Aufklären der komplexen Mikroumgebung des Tumors oder die Entwicklung von individuell zugeschnittenen therapeutischen Interventionen.