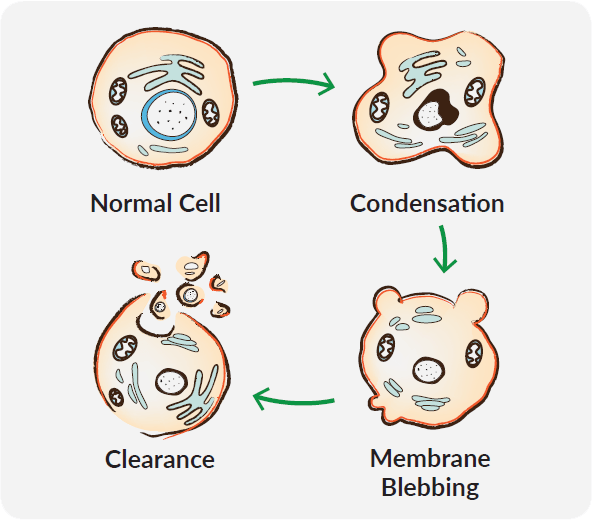
Das Verständnis des Zelltods hat großen Einfluss auf die Behandlung von Krankheiten. Apoptose ist ein genetisch festgelegtes Selbstmordprogramm, mit der überflüssige oder potentiell schädliche Zellen entfernt werden. Apoptose ist ein wichtiger Prozess in der Embryonalentwicklung, der Zellalterung, der Immunantwort und der Reaktion gegen Vergiftungen. Abweichungen in diesem Programm können zu neurodegenerativen oder Autoimmunerkrankungen führen. Außerdem ist die Blockade der Apoptose eines dervon Hanahan und Weinberg postulierten "Kennzeichen von Krebs."1
Apoptose führt durch eine nicht-inflammatorische Kaskade molekularer Ereignisse zu einer deutlichen morphologischen Veränderung der Zelle. Dazu zählt die Reduktion des Zellvolumens, die Fragmentierung des Zellkerns, die Kondensation des Chromatins, die Degradation der DNA, die Bläschenbildung an der Zellmembran und die nachfolgende Bildung von Apoptosekörperchen. Diese Abfolge führt nicht nur zur Zerstörung ungewollter Zellen, sondern bereitet die Zelltrümmer gleichzeitig für die Entfernung durch Phagozyten vor. In Anbetracht der Vielfalt der apoptotischen Reize und deren Einflüsse auf verschiedene Signalwege, ist es wichtig zu verstehen, was genau in einem experimentellen Setup zum Zelltod geführt hat.
Mitochondriales Membranpotential
Mitochondrien sind am apoptotischen Prozess an mehreren Stellen beteiligt. Während des Lebens einer Zelle nutzen Mitochondrien oxidierbare Substrate, um einen Protonengradienten entlang der inneren mitochondrialen Membran zu erzeugen. Während der Apoptose nimmt dieses Membranpotential in Verbindung mit der Öffnung der mitochondrialen Permeabilitätsporen und der Freisetzung von apoptogenen Faktoren wie Cytochrom C ab. In einigen apoptotischen Modellen wird der Verlust des Membranpotentials als ein frühes Ereignis im apoptotischen Prozess angesehen. Andere Forscher vermuten, dass der Verlust des Membranpotentials ein Ergebnis der apoptotischen Signalkaskade ist.2-4 Ein einfacher Weg, um das Membranpotential von Mitochondrien in einer Zellpopulation zu beurteilen ist die Verwendung positiv geladener Farbstoffe wie JC-1 und TMRE, die sich im elektronegativen Inneren aktiver Mitochondrien ansammeln.
JC-1/TMRE
JC-1 wechselt von roter Fluoreszenz in gesunden Mitochondrien zu grüner Fluoreszenz wenn, wie bei der Apoptose das Membranpotential verloren geht. TMRE akkumuliert in polarisierten Mitochondrien und eignet sich vor allem zur Beobachtung des Membranpotentials lebender Zellen. Depolarisierte Mitochondrien mit vermindertem Membranpotential sind nicht in der Lage TMRE zu akkumulieren.
Caspase-Aktivierung
Die Schlüsselfiguren des apoptotischen Signalwegs sind Cystein-abhängige ASPartat-spezifische ProteASEN (Caspasen), deren effiziente Aktivierung die Entscheidung über das Zellschicksal fällt. Caspasen werden durch mehrere Signalwege aktiviert und bilden dabei sich verstärkende Schleifen. Der äußere Signalweg beinhaltet die Bindung extrazellulärer Todesliganden wie FasL oder TNF-α an transmembrane Todesrezeptoren, die wiederum die Initiator-Caspase-8 rekrutieren. Im inneren Signalweg kann das von Mitochondrien freigesetzte Cytochrom C die Bildung des Caspase-aktivierenden Komplexes (auch Apoptosom genannt) auslösen. Dieser wiederum rekrutiert und aktiviert die Initiator-Caspase-9. Die Initiator-Caspasen spalten und aktivieren anschließend die Effektor-Caspasen 3 und 7 und führen zu einer Spaltung spezifischer Substrate, was in direkter Folge zu den morphologischen Veränderungen führt, die klassischerweise die zelluläre Apoptose definieren.5 Damit ist die Messung der Caspase-Aktivität ein wichtiger Indikator des laufenden apoptotischen Prozesses.
Caspase-3/7
Die Protease-Aktivität der Caspasen 3 und 7 kann mit Hilfe des fluorogenen Substrats N-Ac-DEVD-N'-MC-R110 nachgewiesen werden, welches bei der Spaltung ein fluoreszentes Produkt erzeugt.
Kernfragmentierung, Chromatin-Kondensation und DNA-Degradation
Caspasen sorgen auch für den Abbau interner Zellstrukturen und helfen bei deren effizienter Entsorgung. Eines der bemerkenswertesten Ereignisse dieses Prozesses ist die Kondensation des Zellkerns und dessen Zerfall in kleinere Fragmente. Die Kernfragmentierung resultiert aus der Auflösung der Kernlamina nach der Proteolyse durch Caspasen und dem Zusammenbruch der Kernhülle. Ein weiteres charakteristisches Merkmal der Apoptose ist die Kondensation des Chromatins, begleitet von einer Hydrolyse der Kern-DNA. Hoechst 33342, ein zellgängiger, fluoreszenter DNA-Farbstoff, wird oft verwendet, um die Chromatin-Kondensation mikroskopisch zu analysieren. Der Golgi, das Endoplasmatische Retikulum und das mitochondriale Netzwerk zerfallen ebenfalls während der Apoptose. Während des Abbaus werden die Bruchstücke in Bläschen entlang der Plasmamembran verteilt.
DNA-Farbstoffe
Hoechst-Farbstoffe sind zellgängig und binden Nukleinsäuren in lebenden und fixierten Zellen. Ihr blaues, und damit wenig mit anderen Farbstoffen überlappendes, Emissionsspektrum macht sie empfehlenswert für Forscher, die planen, mehrere fluoreszierende Färbungen an einer Probe vorzunehmen. Ein alternativer zellgängiger DNA-Farbstoff ist DRAQ5™, dessen tief-rotes Anregungsspektrum mit Fluorophoren kombiniert werden kann, die blaues und oranges Licht emittieren. Nicht-membrangängige Farbstoffe wie Propidiumiodid, DAPI, DRAQ7™ oder RedDot™2 eignen sich hervorragend für die spezifische Färbung der Kerne toter Zellen, bei denen die Integrität der Plasmamembran beeinträchtigt ist.
Bläschenbildung
Caspasen spalten auch viele Hauptbestandteile des Cytoskeletts und tragen dadurch zur Abrundung und zum Rückzug der Zellen bei, was typisch für frühe Stadien der Apoptose ist. Ein weiteres Ergebnis der Schwächung des Cytoskeletts ist die Bildung von Membran-Bläschen. Wenn das Cytoplasma gegen geschwächte Bereiche der Plasmamembran drückt, zeigen diese sich als mikroskopisch visualisierbare Ausbuchtungen. Es wird angenommen, das diese Bläschen ein Ergebnis myosinabhängiger Kontraktion kortikaler Aktin-Bündel sind, welche das Cytoplasma gegen den Zellkortex drücken. Bläschenbildung an der Plasmamembran ist ein wichtiger Schritt auf dem Weg der apoptotischen Zelle hin zu den kleineren Apoptosekörperchen.
Beseitigung apoptotischer Zellen
Eine kritische Komponente des apoptotischen Prozesses ist das komplette Fehlen einer entzündlichen Reaktion auf sterbende Zellen. Der Zerfall der apoptotischen Zellen in Apoptosekörperchen verhindert die Freisetzung der Damage-Associated Molecular Patterns (DAMPs) in den extrazellulären Raum und erleichtert dadurch die Entsorgung durch Phagozyten. Bereits in der frühen Apoptose sezernieren apoptotische Zellen ein "Finde mich"- und später ein "Friss mich"-Signal, um Fresszellen zu rekrutieren. Diese gezielte Interaktion zwischen apoptotischen Zellen und Phagozyten stellt sicher, dass sterbende Zellen durch den nicht-entzündlichen Signalweg beseitigt werden. Zu den "Finde mich"-Signalen, die Phagozyten rekrutieren, gehören Lysophosphatidylcholin, Sphingosin-1-Phosphat, Fraktalkin und Nukleotide wie ATP und UTP. Diese Nukleotide werden durch eine Caspase-vermittelte Kanalöffnung der Pannexin-1 (PANX1) Kanäle ausgeschüttet.6 Die Caspase-abhängige PANX1 Kanalöffnung erlaubt auch das Einströmen einer kleinen Gruppe fluoreszierender monomerischer Cyaninfarbstoffe wie TO-PRO®-3. So können die Pannexin-Kanäle genutzt werden, um Zellen zu identifizieren, die "Finde mich"-Signale aussenden.7
Sobald sich Phagozyten einer apoptotischen Zelle nähern, erkennen diese Phosphatidylserin- und Phosphatidylethanolamin-Reste, die aus dem Inneren der Phospholipid-Doppelmembran stammen und jetzt auf der Zelloberfläche exponiert werden. Diese für apoptotische Zellen typische Umlagerung unterscheidet sie von den lebensfähigen Gegenstücken und liefert den Phagozyten ein "Friss mich"-Signal. Das Phospholipid-bindende Protein Annexin V haftet an Phospholipid-Resten, die bei der Apoptose exponiert werden. Es wird verwendet, um Phosphatidylserin an der äußeren Membran von apoptotischen Zellen nachzuweisen und die "Friss mich"-Phase der Apoptose zu bestimmen.8,9
TO-PRO®-3
TO-PRO®-3 ist ein tiefroter Fluoreszenzfarbtoff, der die Erkennung eines frühen Ereignisses der Apoptose ermöglicht. Der Farbstoff nutzt die Caspase-abhängig aktivierten Pannexin-Kanäle, um in die Zellen einzudringen. Dadurch ist es möglich, auch apoptotische Zellen zu identifizieren, die mit Hilfe traditioneller Marker wie Annexin V aufgrund des gerade erst begonnenen Prozesses noch nicht nachweisbar sind.
Annexin V
Annexin V kann mit verschiedenen Fluorochromen konjugiert werden (bspw., FITC, PE, APC), um Phosphatidylserin an der äußeren Plasmamembran anzufärben. Der Nachweis mit Annexin V kann mit weiteren Markern, wie solchen für Membranintegrität (bspw., RedDot™2, Propidiumiodid, DAPI) kombiniert werden, um apoptotische von nekrotischen Zellen zu unterscheiden.
Multiplex ist Trumpf
Die oben genannten morphologischen Merkmale des apoptotischen Signalwegs können helfen, die Art des Zelltods in einem Modellsystem zu bestimmen. Jedoch kann eine einzelne Messung bei bestimmten experimentellen Fragestellungen (bspw. der Unterscheidung zwischen Nekrose und Apoptose) zu Fehlinterpretationen führen. Multiplex-Assays liefern im Gegensatz zu Einzelmessungen ein vollständigeres Bild des apoptotischen Prozesses. Beispielsweise erlaubt die kombinierte Messung mit TO-PRO®-3, Annexin V, TMRE und DAPI eine gleichzeitige Aussage zu "Finde mich" oder "Friss mich"-Signalen, dem mitochondrialen Membranpotential und der Kernfragmentierung. Multiplex-Assays liefern somit ein komplexes Abbild der apoptotischen Vorgänge und wie diese auf Zellen einwirken. Darüber hinaus können mit Markern für die frühe Apoptose (bspw. TO-PRO®-3) Zellen als apoptotisch identifiziert werden, die aufgrund der Beschränkungen traditioneller Apoptosemarker (bspw. Annexin V), als lebensfähig angesehen wurden. Muliplex-Methoden ermöglichen somit, durch den Einsatz verschiedener Marker für die unterschiedlichen Phasen der Apoptose, eine quantitative Einteilung der gesamten Zellpopulation in die Stadien: lebensfähig, frühe Apoptose, späte Apoptose, Apoptosekörperchen und nicht-zelluläre Trümmer.
Die Auswahl an zellbasierten Assays von Cayman Chemical liefern Ihnen flexible und effiziente Werkzeuge zur Bestimmung der unterschiedlichen Stadien des Zelltods in Ihrem Modellsystem. Biomols Technischer Support und Caymans Produktentwickler helfen Ihnen gerne, den für Sie passenden zellbasierten Assay auszuwählen, damit Sie in der Lage sind, die genauesten Antworten zu Ihren Forschungsfragen zu erhalten.
Referenzen
- Hanahan, D. and Weinberg, R.A. Cell 144(5), 646-674 (2011).
- Gottlieb, E., Armour, S.M., Harris, M.H., et al. Cell Death Differ. 10(6), 709–717 (2003).
- Ly, J.D., Grubb, D.R., and Lawen, A. Apoptosis 8(2), 115-128 (2003).
- Vakifahmetoglu-Norberg, H., Ouchida, A.T., and Norberg, E. Biochem. Biophys. Res. Commun. 482(3), 426-431 (2017).
- Taylor, R.C., Cullen, S.P., and Martin, S.J. Nat. Rev. Mol. Cell Biol. 9(3), 231-241 (2008).
- Chekeni, F.B., Elliott, M.R., Sandilos, J.K., et al. Nature 467(7317), 863-867 (2010).
- Jiang, L., Tixeira, R., Caruso, S., et al. Nat. Protoc. 11(4), 655-663 (2016).
- van Engeland, M., Nieland, L.J., Ramaekers, F.C., et al. Cytometry 31(1), 1-9 (1998).
- Logue, S.E., Elgendy, M., and Martin, S.J. Nat. Protoc. 4(9), 1383-1395 (2009).