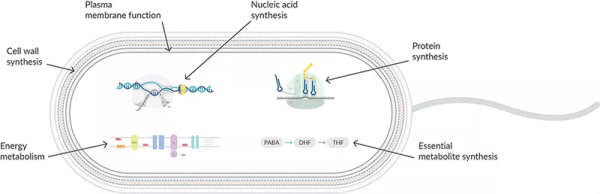
β-Lactam-Antibiotika, einschließlich Penicilline, Cephalosporine, Monobactame und Carbapeneme, zeichnen sich durch einen Lactamring in ihrer Molekülstruktur aus. Sie wirken über die Hemmung der Synthese der Peptidoglykanschicht der bakteriellen Zellwände. β-Lactam-Antibiotika inhibieren die Transpeptidase-, Transglykosylase- und/oder Carboxypeptidase-Aktivitäten speziesspezifischer, membrangebundener Penicillin-bindender Proteine (PBPs), die die Vernetzung der Zellwandkomponenten während der letzten Phase der bakteriellen Zellwandsynthese ermöglichen (Abbildung 1). Dies geschieht durch Bindung an das terminale D-Ala-D-Ala in der sich verlängernden Peptidoglykanstruktur und Acylierung des Serins am aktiven Zentrum des PBP. Darauf folgt eine sehr langsame Deacylierung, die das PBP inaktiviert. Während die Zelle wächst, ist sie nicht mehr in der Lage, genug Zellwandbestandteile zu synthetisieren. Infolgedessen wird der Druck im Inneren der Zelle größer und die Plasmamembran wird an einer Schwachstelle aus der Zellwand herausgedrückt. Schließlich platzt diese wie ein Ballon. Da die Bildung einer Teilungsfurche zur Bildung neuer Tochterzellen von der Fähigkeit abhängt, eine neue Zellwand zu synthetisieren, ist die Zelle auch nicht in der Lage sich zu teilen. Ein extrem verletzlicher Sphäroplast bildet sich, wenn die Zellwand vollständig abfällt. In dieser Form verlieren die Bakterien die Kontrolle über ihre Form, und durch die Verdoppelung eines Großteils ihres genetischen und metabolischen Materials wird die Homöostase weiter gestört. Diese Mechanismen führen letzendlich zum Zelltod des Bakteriums.
Bakterien können eine Resistenz gegen β-Lactam-Antibiotika entwickeln, indem sie β-Lactamase synthetisieren Dies ist ein Enzym, das den β-Lactam-Ring angreift, um das Antibiotikum zu inaktivieren. Mehr als 1.000 einzigartige β-Lactamasen sind bekannt. Um diese Resistenz zu überwinden, werden β-Lactam-Antibiotika in der Regel zusammen mit β-Lactamase-Inhibitoren verabreicht. Efflux und Modifikation oder Deletion der Porinfunktion können ebenfalls eine Rolle bei der Resistenz gegen einige β-Lactame in Verbindung mit der β-Lactamase-Produktion spielen, was zu einer Resistenz gegen praktisch alle β-Lactame führt. Einige Bakterien sind auch in der Lage neue PBPs zu erwerben, die eine geringe Affinität zu β-Lactamen haben. Das bekannteste Beispiel für diese Resistenzstrategie ist der Methicillin-resistente S. aureus (MRSA), der ein PBP mit geringer Affinität für fast alle entwickelte β-Lactame erworben hat.

Abbildung 1: Antibiotika hemmen verschiedene Prozesse bei der Synthese der Peptidoglykan-Zellwand. Gram-negative Zellwände bestehen aus zwei Schichten außerhalb der Zellmembran - einer dünnen Peptidoglykanschicht und einer äußeren Membran mit Porinen, durch die bestimmte Antibiotika, nicht aber Glykopeptide, zu ihrem Wirkort diffundieren können. Gram-positive Bakterien haben eine dickere Peptidoglykanschicht, aber keine zusätzliche äußere Hülle, sodass Glykopeptide zum Wirkort gelangen können.
Glykopeptide und Lipoglykopeptide bestehen aus glykosylierten zyklischen oder polyzyklischen nichtribosomalen Peptiden, die die Zellwandbildung stören, indem sie einen Komplex zwischen dem Antibiotikum und dem C-terminalen D-Ala-D-Ala-Dipeptid des naszierenden Peptidoglykans auf der äußeren Oberfläche der Zellmembran von Gram-positiven Bakterien bilden (Abbildung 1). Die Bildung dieses Komplexes verhindert die Transglykosylierungs- und Transpeptidierungsreaktionen, die für die Vervollständigung der Peptidoglykan-Kette notwendig sind. Dies führt zu einer unvollständigen Zellwand und letzendlich zum Zelltod. Sie sind zu groß, um die Porinkanäle in der äußeren Membran von gramnegativen Bakterien zu passieren. Zusätzlich zur Wechselwirkung mit D-Ala-D-Ala binden einige Antibiotika dieser Gruppe an Lipid II. Dabei handelt es sich um einen Zellwandvorläufer auf der zytoplasmatischen Seite der Zellmembran, der durch die Zellmembran transportiert werden muss, um sein Disaccharid-Pentapeptid-Monomer für die Vernetzung in Peptidoglycan zu liefern und einzubauen. Diese Interaktion führt zu einer Depolarisation der Membran und schließlich zu einer Beschädigung, die zum Zelltod führt. Da Glykopeptide auf die äußere Oberfläche der Zellwand zielen, müssen sie keine Membranbarriere überwinden und interagieren nicht mit Enzymen. Bekannte Glykopeptid-Resistenzmechanismen sind stattdessen mit strukturellen Modifikationen in den Substraten für die Enzyme verbunden, welche die finalen Aminosäuren in die Pentapeptid-Vorstufen einbauen. Die relevantesten Modifikationen beinhalten den Ersatz des C-terminalen D-Ala durch D-Lactat oder D-Serin, was zu D-Ala-D-Lac oder D-Ala-D-Ser Peptidsequenzen mit reduzierter Bindungsaffinität für das Antibiotikum führt.
Die Phosphonsäure Fosfomycin inhibiert das Wachstum einer Vielzahl von Bakterien, indem sie die Enolpyruvyltransferase MurA blockiert. Diese katalysiert den ersten Schritt der Peptidoglykansynthese, der für die Zellwandbildung essentiell ist (Abbildung 1). Fosfomycin gelangt über Glycerin-3-Phosphat- und Hexose-6-Phosphat-Transporter in die Zellen. Mutationen in diesen Transportern, die einen erhöhten Efflux oder eine verminderte zelluläre Aufnahme verursachen, können zu Resistenzen führen. Spezifische MurA-Gen-Mutationen, die ein Enzym mit reduzierter Affinität für Fosfomycin produzieren, oder eine erhöhte Expression von MurA, die die Kapazität von Fosfomycin zur Wachstumshemmung übersteigt, sind ebenfalls bekannte Ursachen für eine Resistenz. Fosfomycin-inaktivierende Enzyme sind ebenfalls bekannt.