Originalartikel von Joseph Meacham (AAT Bioquest)
Bei so vielen Auswahlmöglichkeiten kann es schwierig und mühsam sein, den geeigneten Calcium-Indikator für einen bestimmten Calcium-Ionenfluss-Assay zu finden. Um den Prozess zu vereinfachen, finden Sie hier die acht besten grün fluoreszierenden Calcium-Indikatoren für Einzelwellenlängenmessungen.
Einführung
Calcium ist ein ubiquitäres Ion, das an vielen physiologischen Prozessen beteiligt ist. Zum Beispiel kann Calcium als Botenstoff (second messenger) in physiologischen Signalwegen fungieren und die Freisetzung von Neurotransmittern aus Neuronen auslösen. Außerdem spielt es eine wesentliche Rolle als Enzym-Cofaktor und ist für die Kontraktion aller Muskelzellen unerlässlich. Da die physiologische Regulierung der Ca2+-Konzentration notwendig ist, um solche lebenswichtigen zellulären Prozesse zu initiieren und aufrechtzuerhalten, wurden viele qualitative und quantitative Methoden zur Messung der Ca2+-Konzentration entwickelt.
Ein bekannter Signalweg, der die Ca2+-Konzentration im Cytoplasma reguliert, ist der Phospholipase-C-Signalweg. Dieser Signalweg wird durch die Aktivierung von G-Protein-gekoppelten Rezeptoren (GPCR) initiiert. Zur Überwachung der GPCR-Aktivität empfehlen wir robuste Ca2+-Flux-Assays, die hochempfindliche Indikatoren zum Nachweis von Ca2+-Signalen beinhalten. Die Detektion von intrazellulärem Ca2+ wird häufig zur Charakterisierung von GPCR-Agonisten und -Antagonisten in der Medikamentenentwicklung sowie zur Überwachung synaptischer Aktivitäten in der neurowissenschaftlichen Forschung durchgeführt.
| Indikator | AM1 | Salz2 | Dextran3 | Ex/Em (nm) | FCa/Ffrei4 | Format | Kd (nM) | Helligkeit5 | SNR5 |
| Fluo-3 | Ja | Ja | Nein | 506/526 | ~100 | Fluo-3 | 390 | * | * |
| Fluo-4 | Ja | Ja | Nein | 494/516 | ~100 | Fluo-4 | 345 | ** | ** |
| Fluo-8 | Ja | Ja | Nein | 494/517 | ~200 | Fluo-8 | 390 | *** | *** |
| Fluo-8H | 232 | *** | *** | ||||||
| Fluo-8FF | 10000 | *** | *** | ||||||
| Fluo-8L | 1900 | *** | *** | ||||||
| Cal-520 | Ja | Ja | Ja | 494/514 | ~100 | Cal-520 | 320 | *** | *** |
| Cal-520FF | 9800 | *** | *** | ||||||
| Calbryte-520 | Ja | Ja | Nein | 492/514 | ~300 | Calbryte-520 | 1200 | ***** | ***** |
| Calcium Green-1 | Ja | Ja | Ja | 506/531 | ~14 | Calcium Green-1 | 190 | *** | *** |
| Calcium Green-5N | Ja | Ja | Nein | 506/531 | ~38 | Calcium Green-5N | 14000 | *** | *** |
| Oregon Green 488 BAPTA-1 | Ja | Ja | Ja | 494/523 | ~14 | Oregon Green 488 BAPTA-1 | 170 | *** | *** |
- AM: zellpermeabler Acetoxymethylester.
- Salz: zellimpermeable Salzderivate (Natrium-, Ammonium- oder Kaliumsalze).
- Dextran: zellimpermeable Dextran-Konjugate.
- FCa/Ffrei: Fluoreszenzintensität des Ca2+-gebundenen Indikators relativ zu seiner Ca2+-freien Indikatorform.
- Fluoreszenzhelligkeit und Signal-Rausch-Verhältnis (SNR) abgestuft auf einer Skala * (geringe Helligkeit) bis ***** (sehr hell).
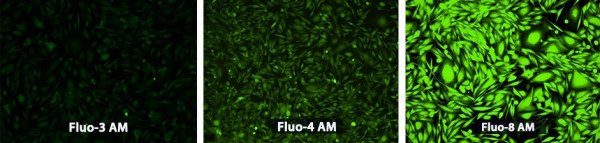
Fluo-3
Fluo-3 ist einer der am häufigsten verwendeten grünen Calcium-Indikatoren auf dem Markt. Er wurde erstmals von Tsien und Kollegen in den späten 1980er Jahren entwickelt (Grynkiewicz et al. 1985). Seitdem wurden Fluo-3 und seine Analoga in vielen Ca2+-Imaging-Anwendungen eingesetzt. Sie leisten einen wesentlichen Beitrag zum Verständnis der räumlichen Dynamik von Prozessen, die mit Ca2+-Signalwegen verbunden sind.
Fluo-3 ist ein mit sichtbarem Licht anregbarer Einzelwellenlängen-Indikator mit ähnlichen spektralen Eigenschaften wie Fluorescein. Fluo-3 wird durch die Argon-Laserlinie bei 488 nm gut angeregt und kann mit den FITC-Emissionsfiltersätzen visualisiert werden. Es hat ein Absorptions- und Emissionswellenlängenmaximum bei 506 nm bzw. 526 nm. Im Vergleich zu anderen Ca2+-Indikatoren hat Fluo-3 eine relativ geringe Affinität für Ca2+. Fluo-3 weist eine Calcium-Dissoziationskonstante (Kd) von ~390 nM auf, die Probleme beruhend auf der cytosolischen Pufferung bei Ca2+-Spiegeln von ~100 nM abmildern kann. In der Ca2+-freien Form ist Fluo-3 quasi nicht fluoreszierend. Nach der Bindung von Ca2+ steigt die Fluoreszenzintensität von Fluo-3 um das ~100-fache und weist bei sättigenden Ca2+-Spiegeln eine Quantenausbeute von ~0,14 auf.
In Vergleichsstudien zeigten mit Fluo-3 beladene Zellen einen großen dynamischen Umfang, der empfindlich auf elementare und globale Ca2+-Ströme reagierte. Fluo-3 erfordert jedoch eine Inkubation bei 37 °C, was zu einem signifikanten Indikatorverlust durch die erhöhte Aktivität von Anionentransportern führt, die bei der gleichen Temperatur aktiv sind. Um die zelluläre Retention zu verbessern, wird Probenecid, ein organischer Anionentransporter-Inhibitor, während der Zellbeladung verwendet. Leider kann Probenecid für Zellen toxisch sein und während es bestimmte Anionentransporter hemmt, kann es andere aktivieren. Jedoch ist Fluo-3 nicht nur empfindlich gegenüber Temperaturschwankungen, sondern auch pH-sensitiv und empfindlich gegenüber Proteinbindung.
Fluo-4
Fluo-4 ist ein durch sichtbares Licht anregbarer Calcium-Indikator, der basierend auf seinem Vorgänger, Fluo-3, entwickelt wurde. Wie Fluo-3 ist Fluo-4 ein nicht-fluoreszierender Indikator, dessen Intensität bei Bindung von Ca2+ um das ~100-fache ansteigt, jedoch geringfügige strukturelle Veränderungen aufweist, die zu einem helleren und photostabileren Indikator führen. Durch das Ersetzen von zwei Chlorsubstituenten durch Fluor zeigt Fluo-4 eine Wellenlängenverschiebung von ~12 nm in Richtung des blauen Spektrums. Dies führt zu einer neuen maximalen Absorptionswellenlänge bei 494 nm, wodurch Fluo-4 effizienter durch die Argon-Laserlinie bei 488 nm angeregt werden kann. Dies führt zu einem helleren Fluoreszenzsignal bei niedrigeren Farbstoffkonzentrationen, wodurch Fluo-4 im Vergleich zu Fluo-3 weniger phototoxisch ist. Fluo-4 hat eine etwas höhere Ca2+-Bindungsaffinität als Fluo-3, mit einem Kd-Wert von 345 nM. Aus diesen Gründen ist Fluo-4 eine bessere Alternative für die Verwendung mit konfokaler Mikroskopie als Fluo-3.
Obwohl Fluo-4 ein helleres Signal und ein verbessertes Signal-Rausch-Verhältnis bei der Analyse der Ca2+-Ströme von adhärenten Zellen zeigt, ist es in lebenden Proben immer noch nur mäßig fluoreszierend. Wie bei seinem Vorgänger Fluo-3 wird auch bei Fluo-4 zur Verbesserung der Farbstoffretention Probenecid eingesetzt, das bekanntermaßen toxisch für Zellen ist.
Fluo-8
Fluo-8 ist ein neuartiger grüner Calcium-Indikator, der denselben Fluorescein-Kern enthält, der auch in Fluo-3 und Fluo-4 verwendet wird, um die Ca2+-Konzentration und den Ca2+-Strom in Zellen zu überwachen. Dadurch behält Fluo-8 die gleichen spektralen Eigenschaften wie Fluo-4 und behebt gleichzeitig die Einschränkungen, die Fluo-3 und Fluo-4 aufweisen. Geringfügige strukturelle Modifikationen haben zu mehreren Verbesserungen geführt, beispielsweise die verbesserten Ladebedingungen von Fluo-8. Im Vergleich zu Fluo-3 und Fluo-4, die eine Beladung des Indikators bei einer Temperatur von 37 °C erfordern, kann Fluo-8 erfolgreich bei Raumtemperatur beladen werden, was die dafür benötigte Zeit auf 20 Minuten reduziert.
Wie die anderen Fluo-Farbstoffe ist auch Fluo-8 in der Ca2+-freien Form nicht fluoreszierend. Nach Bindung an Ca2+ zeigt Fluo-8 einen starken Anstieg der Fluoreszenzintensität um das ~200-fache. Insgesamt ist Fluo-8 doppelt so hell wie Fluo-4 und vier Mal heller als Fluo-3. Fluo-8 ist im Vergleich zu anderen Sonden weniger temperaturabhängig, was konsistentere und reproduzierbare Ergebnisse sowohl bei Raumtemperatur als auch bei 37 °C ermöglicht. Fluo-8 und seine Analoga sind in vier verschiedenen Formen erhältlich, die jeweils unterschiedliche Calcium-Bindungsaffinitäten aufweisen. Fluo-8 hat eine Kd von ~ 389 nM, Fluo-8H hat eine Kd von ~ 232 nM, Fluo-8L hat eine Kd von ~1,86 μM und Fluo-8FF hat eine Kd von ~10 μM. Fluo-8L und Fluo-8FF haben deutlich geringere Ca2+-Bindungsaffinitäten und eignen sich daher besser für den Nachweis intrazellulärer Ca2+-Konzentrationen im mikromolaren Bereich.
Cal-520
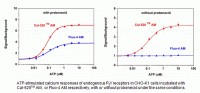
Cal-520 ist ein neuartiger fluoreszierender Calcium-Indikator mit mehreren bemerkenswerten Verbesserungen und Vorteilen im Vergleich zu älteren Generationen von Ca2+-Indikatoren wie Fluo-3 und Fluo-4. Eine Verbesserung bei Cal-520 ist eine Verschiebung seiner optimalen Absorptions- und Emissionswellenlängen um ~12 nm, was zu einer maximalen Absorptionswellenlänge von 494 nm führt. Dadurch ist im Fall von Cal-520 die Effizienz der Anregung bei 488 nm durch den Argon-Laser auf 94% der Peak-Maxima erhöht, was deutlich effizienter ist als 40 % bei Fluo-3. Mit einem Emissionsmaximum bei 514 nm ist Cal-520 ein hervorragender Indikator für Multiplexing-Anwendungen, bei denen ein Indikator mit roter Fluoreszenz eingesetzt wird. Zusätzlich erlaubt die verbesserte Anregungseffizienz von Cal-520 die Verwendung bei weniger toxischen oder niedrigeren Farbstoffkonzentrationen. Dies ist vorteilhaft für Experimente zur Untersuchung von intrazellulärem Ca2+ mittels konfokaler Mikroskopie, da die Auswirkungen der Fluoreszenzsättigung reduziert werden.
Im Vergleich zu Fluo-3 und Fluo-4 hat Cal-520 eine etwas höhere Affinität für Ca2+ mit einem Kd-Wert von 320 nM. Zusätzlich ist Cal-520 optimiert und im Cytosol lokalisiert. Dies reduziert die Kompartimentierung des Indikators in Organellen wie den Mitochondrien und stellt sicher, dass das detektierte Signal ein genaues Abbild der Konzentrationsänderungen des freien Ca2+ im Cytosol ist. Cal-520 ist eine robuste Sonde für fluoreszenzbasierte Assays zum Nachweis der intrazellulären Calciummobilisierung. Sie ist hochempfindlich für die Evaluierung von GPCR- und Calciumkanal-Targets sowie für das Screening ihrer Agonisten und Antagonisten.
Cal-520 ist in den Formen AM-Ester, Salz, Dextran-Konjugat und Biokonjugat erhältlich, um jedem experimentellen Design gerecht zu werden. Ein wesentlicher Vorteil der Verwendung von Cal-520 AM ist der Verzicht auf Probenecid, das für lebende Zellen toxisch sein kann. Cal-520 Biokonjugate, wie Cal-520 Biocytin und Biotin, können sowohl an Avidin als auch an Streptavidin binden, ohne die Empfindlichkeit zum Nachweis von Ca2+-Reaktionen zu verändern. Cal-520 Dextran-Konjugate können mikroinjiziert oder von Zellen über Endozytose aufgenommen werden. Je nach untersuchten Gewebetyp empfehlen sich Cal-520-Konjugate mit Dextran-Molekülen von 3.000 oder 10.000 Da.
Calbryte-520
Calbryte-520 ist ein Ca2+-Indikator der nächsten Generation, der kürzlich als Ersatz für herkömmliche grüne Calcium-Indikatoren wie Fluo-3 und Fluo-4 eingeführt wurde. Mit einem Fluoreszenzanregungs- und -emissionsmaximum von 492 nm bzw. 514 nm ist Calbryte-520 der beste Indikator in dieser Aufstellung, der sich für eine effiziente Anregung bei der Argon-Laserlinie von 488 nm eignet. Die spektralen Eigenschaften von Calbryte-520 stimmen eng mit denen von Fluo-4, Calcium Green-1 und Oregon Green 488 BAPTA-1 überein, so dass ein nahtloser Übergang zwischen Calbryte-520 und einem dieser drei Indikatoren möglich ist. Calbryte-520 ist entweder als AM-Ester oder als Kaliumsalzderivat erhältlich. Calbryte-520 als AM-Ester eignet sich aufgrund seiner Zellpermeabilität für die Bestimmung von Ca2+-Konzentrationen in lebenden Zellen, während Calbryte-520 als Kaliumsalz aufgrund seiner Zellimpermeabilität für die Kalibrierung von Ca2+-Indikatoren geeignet ist.
Bei der Entwicklung von Calbryte-520 lag der Schwerpunkt auf der Verbesserung des Signal-Rausch-Verhältnisses. Um Hintergrundstörungen zu reduzieren, zeigt Calbryte-520 (AM) nur eine mininmale Reaktion auf Spuren von Ca2+ in extrazellulärer Lösung und bleibt dadurch inaktiv und nicht fluoreszierend. AM-Ester erleichtern die passive Diffusion von Calbryte-520 durch die Zellmembran, wo unspezifische intrazelluläre Esterasen die funktionellen AM-Ester-Gruppen abspalten und so die Fluoreszenz von Calbryte-520 und seine Reaktionsfähigkeit auf Ca2+ aktivieren. Ein wesentlicher Vorteil bei der Verwendung von Calbryte-520 ist der Verzicht auf Probenecid zur Verbesserung der Farbstoffretention (außer Cal-520 benötigen alle anderen in dieser Liste genannten Ca2+-Indikatoren Probenecid). Aktiviertes Calbryte-520 weist eine ausgezeichnete zelluläre Retention und Lokalisierung im Cytosol auf. Dadurch wird sichergestellt, dass das detektierte Signal eine genaue Bewertung der intrazellulären Ca2+-Konzentration darstellt.
Wie bei allen Calcium-Indikatoren nimmt die Fluoreszenzintensität von Calbryte-520 nach der Chelatisierung mit freiem Ca2+ zu. Der ~300-fache Anstieg der Fluoreszenzintensität von Calbryte-520 ist der größte, gefolgt vom ~200-fachen Anstieg von Fluo-8 und einem ~100-fachen Anstieg von Fluo-3, Fluo-4, Cal-520 und Oregon Green 488 BAPTA-2. Die Quantenausbeute von Calbryte-520 ist dreimal größer als die von Fluo-3 oder Fluo-4 und es weist einen Kd-Wert von 1200 nM auf. Diese Eigenschaften machen Calbryte-520 zu einem hochsensiblen Indikator für Calcium-Flux-Assays und für das Hochdurchsatz-Screening von GPCR-Agonisten und -Antagonisten. Calbryte-520 ist für die Anwendung in der konfokalen Lasermikroskopie und der Durchflusszytometrie sowie für Messungen mittels Fluoreszenz-Mikroplattenreadern optimiert.
Calcium Green-1
Calcium Green-1 ist ein durch sichtbares Licht anregbarer Indikator, der von Fluorescein abgeleitet ist. Wie seine oben erwähnten Vorgänger Fluo-3 und Fluo-4 zeigt Calcium Green-1 eine Zunahme seiner Fluoreszenz-Emissionsintensität bei Bindung an freies Ca2+. Mit einer maximalen Absorptions- und Emissionswellenlänge von 506 nm bzw. 531 nm eignet sich Calcium Green-1 für die Anregung mit der Argon-Laserlinie und wird mit einem FITC-Emissionsfilterset visualisiert.
Verglichen mit der ~100-fachen Intensitätssteigerung bei Fluo-3 und Fluo-4 fällt bei Calcium Green-1 der Anstieg der Fluoreszenzintensität um den Faktor 14 wesentlich geringer aus. Allerdings weist es eine stärkere Affinität zu Ca2+ auf, mit einem Kd-Wert von 190 nM und einer deutlich größeren Quantenausbeute von 0,75 bei sättigenden Ca2+-Konzentrationen. Bei niedrigeren Ca2+-Konzentrationen ist Calcium Green-1 stärker fluoreszierend als Fluo-3, was die Sichtbarkeit ruhender Zellen verbessert und die Bestimmung der Basisfluoreszenz und somit der Ca2+-Konzentration erleichtert. Diese Eigenschaften reduzieren auch die phototoxischen Effekte von Calcium Green-1. Da Calcium Green-1 intrinsisch fluoreszierender ist, erfordert es geringere Beleuchtungsintensitäten und niedrigere Farbstoffkonzentrationen als Fluo-3. Leider benötigt Calcium Green-1, wie Fluo-3 und Fluo-4, zur verbesserten zellulären Retention Probenecid, das für Zellen toxisch sein kann.
Calcium Green-1 ist als zellpermeabler AM-Ester oder in Form zellimpermeabler Dextran-Konjugate und Salzderivate erhältlich, die für verschiedene Calcium-Signaluntersuchungen geeignet sind, einschließlich Ca2+-Flux-Assays und Multiphotonenmikroskopie in lebendem Gewebe. Calcium Green-1 ist außerdem anpassbar für verschiedene fluoreszenzmikroskopische Anwendungen und geeignet für die Durchflusszytometrie.
Calcium Green-5N
Calcium Green-5N ist ein vergleichsweise schwach affiner Ca2+-Indikator mit spektral identischen Eigenschaften wie Calcium Green-1. Von allen in dieser Liste genannten Ca2+-Indikatoren hat Calcium Green-5N die schwächste Affinität für Ca2+ mit einer größeren Dissoziationskonstante bei ~14 μM. Im Vergleich zu Indikatoren mit Kd-Werten < 1 μM ist Calcium Green-5N aufgrund seiner größeren Kd besser geeignet, um die Kinetik der schnellen Calcium-Dynamik zu verfolgen. In früheren Studien hat sich Calcium Green-5N als geeignete Methode zur Messung von Ca2+-Konzentrationen über 50 μM erwiesen. In Verbindung mit hochaffinen Ca2+-Indikatoren kann Calcium Green-5N einen Hinweis auf die absolute Größe von Ca2+-Ausschlägen in Zellen geben.
Nach der Bindung an freies Ca2+ erfährt Calcium Green-5N einen Anstieg der Fluoreszenzintensität um das ~ 38-fache, was doppelt so hoch ist wie der ~ 14-fache Anstieg von Calcium Green-1. Allerdings zeigt Calcium Green-5N selbst bei einer stärkeren Erhöhung der Emissionsintensität relativ wenig Fluoreszenz, außer in Zellen, die einen hohen Ca2+-Fluss aufweisen. Aufgrund dieser Eigenschaften und seiner geringen Affinität für Ca2+ kann sich Calcium Green-5N als unempfindlich bei der Erkennung geringer oder vorübergehender Ca2+-Flüsse erweisen.
Oregon Green 488 BAPTA-1
Oregon Green 488 BAPTA-1 (OG488 BAPTA-1) gehört zur Gruppe hell fluoreszierender Calcium-Indikatoren, die ähnliche spektrale Eigenschaften wie Calcium Green-1 aufweisen. Der Hauptunterschied zwischen den beiden ist die Verschiebung der Fluoreszenzabsorptions- und Anregungsmaxima von OG488 BAPTA-1 um ~10 nm, was zu einer maximalen Absorptionswellenlänge von 494 nm führt. Dies verbessert die Anregungseffizienz von OG488 BAPTA-1 bei der Argon-Laserlinie von 488 nm erheblich. In Ca2+-freien Lösungen ist OG488 BAPTA-1 mäßig fluoreszierend. Nach Bindung an freies Ca2+ erfährt OG488 BAPTA-1 einen Anstieg der Fluoreszenz-Emissionsintensität um das ~14-fache. Wie Calcium Green-1 besitzt OG488 BAPTA-1 eine Quantenausbeute von etwa 0,7 bei einer kleinen Dissoziationskonstante von ~140 nM. Diese spektralen Eigenschaften von OG488 BAPTA-1 erlauben den Einsatz bei niedrigeren Indikator-Konzentrationen, wodurch er sich für die Untersuchung intrazellulärer Ca2+-Konzentrationen mit einem konfokalen Laser-Scanning-Mikroskop eignet. Darüber hinaus sind Studien bekannt, die ein duales Calcium-Indikator-System unter Verwendung von OG488 BAPTA-1 einsetzen. Zum Beispiel wurden Kombinationen von OG488 BAPTA-1 und Fluo-4 verwendet, um Reaktionen zu untersuchen, die einen begrenzten basalen Signalpegel mit einem großen stimulus-abhängigen Anstieg kombinieren.
Referenzen
- Grynkiewicz, G. et al. "A new generation of Ca2+ indicators with greatly improved fluorescence properties." JBC vol. 260, no. 40, pp. 3440-3450, 1985.
- Paredes, R. Madelaine et al. “Chemical Calcium Indicators.” Methods (San Diego, Calif.)3 (2008): 143–151. PMC. Web. 24 Oct. 2017.
- Putney, James W. Calcium signaling. CRC/Taylor & Francis, 2006.
- Sun, W.-C., et al. “ChemInform Abstract: Synthesis of Fluorinated Fluoresceins.” ChemInform, vol. 29, no. 3, 2010.
- Tada, Mayumi et al. “A Highly Sensitive Fluorescent Indicator Dye for Calcium Imaging of Neural Activity in Vitro and in Vivo.” The European Journal of Neuroscience (2014): 1720–1728. PMC. Web. 24 Oct. 2017.
- Thomas, D., et al. “A comparison of fluorescent Ca2 Indicator properties and their use in measuring elementary and global Ca2 Signals.” Cell Calcium, vol. 28, no. 4, pp. 213–223, 2000.










![Cal Green(TM) 1, AM [Equivalent to Calcium Green -1, AM] Cal Green(TM) 1, AM [Equivalent to Calcium Green -1, AM]](https://www.biomol.com/media/image/29/3e/02/ABD-20502_200x200.gif)
![OG488 BAPTA-1, AM [similar to Oregon Green(R) 488 BAPTA-1, AM] *Cell permeant* OG488 BAPTA-1, AM [similar to Oregon Green(R) 488 BAPTA-1, AM] *Cell permeant*](https://www.biomol.com/media/image/c7/07/50/ABD-20507_200x200.png)