Lentiviren werden als virale Vektoren eingesetzt, um eine bestimmte Erbgutsequenz in Zielzellen einzubringen. Sie spielen sowohl in der Forschung, als auch in der Gentherapie eine wichtige Rolle. Doch was sind Lentiviren, wie funktionieren diese viralen Forschungswerkzeuge und welche Anwendungsmöglichkeiten gibt es? Auf diese Fragen gehen wir im folgenden Blog-Artikel näher ein.
Diese Themen warten auf Sie:
2) Lentiviren in der Gentherapie – ein Anwendungsbeispiel
4) Top 10 der meistverkauften Lentivirus-Produke
Jetzt kostenlos für den Biomol-Newsletter anmelden und keinen Blog-Artikel mehr verpassen!
Was sind Lentiviren?
Lentus ist lateinisch für „langsam“ und ist namensgebend für die Gattung der Lentiviren. Sie gehören zu der Familie der Retroviren, von denen Viele langsam fortschreitende, degenerative Krankheiten bei ihrem Wirt verursachen, wodurch sie ihren Namen bekamen. Lentiviren sind behüllte Einzel-Strang-RNA-Viren und haben einen Durchmesser von 80–100 nm [1]. Sie verbleiben ein Leben lang in ihrem Wirt und zeigen eine ausgeprägte Wirtsspezifität. Beispielsweise befällt das Bovine Immundefizienz-Virus (BIV) ausschließlich Rinder, während das Feline Immundefizienz-Virus (FIV) nur Haus- und Großkatzen infiziert. Der wohl bekannteste Vertreter innerhalb der Familie der Retroviren ist das Humane Immundefizienz-Virus (HIV) mit den beiden Arten HIV-1 und HIV-2, welche beim Menschen die Krankheit AIDS auslösen können.
Lentiviren gehören zu den komplexen Retroviren. Sie unterscheiden sich von anderen Retroviren, da ihr Genom noch weitere, regulatorische Gene enthält, die als akzessorische Gene bezeichnet werden. Ein Beispiel dafür ist das nef-Gen (negative factor). Dieses Gen kodiert für ein intrazelluläres Protein, das in der Lage ist, den CD4-Rezeptor herunter zu regulieren, damit dieser nicht mehr an der Zelloberfläche präsentiert wird [2]. Dadurch wird das Immunsystem des Wirtes abgeschwächt und somit die Ausbreitung der Infektion erleichtert. Eine niedrige Zahl an CD4-positiven Zellen deutet auf eine weit fortgeschrittene Immunschwäche hin [3] .
Der Replikationszyklus von Lentiviren gleicht dem anderer Retrovieren (Abb. 1). Um das virale Erbgut in das Wirtszellgenom zu integrieren, muss die Virus-RNA zunächst mit einer Virus-eigenen Reversen Transkriptase in DNA umgeschrieben werden. Im Gegensatz zu z. B. Gammaretroviren können Lentiviren die Kernhülle der infizierten Zelle „aus eigener Kraft“ überwinden und müssen sich nicht die Teilung dieser Zelle zu Nutze machen, um ihre Erbinformationen in die des Wirtes zu integrieren [2]. Diese Eigenschaft macht sie als virale Vektoren in der Forschung und in der therapeutischen Anwendung so interessant. Werden Lentiviren als Vektoren eingesetzt, können sie also Zellen zu jedem Zeitpunkt ihres Zellzyklus transfizieren. Damit ist es in der praktischen Anwendung möglich, ruhende oder sich teilende Zellen sowie immortalisierte oder primäre Zelllinien zu transfizieren [5].
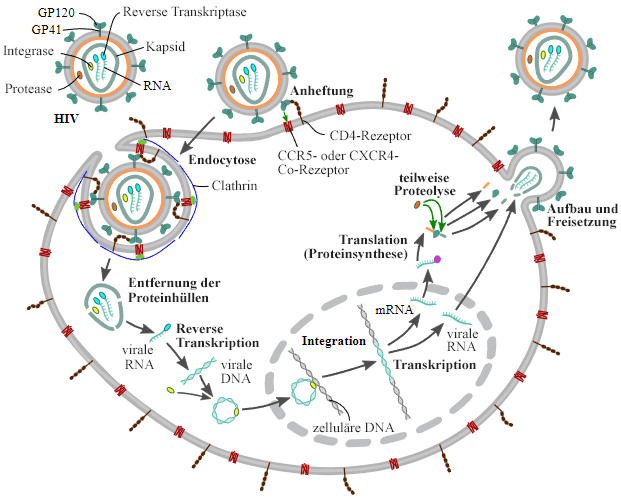
Abb. 1: Replikationszyklus von HIV. Die Bindung an die Wirtszelle stellt den ersten Schritt der Infektion dar. Sie erfolgt unter anderem über das Hüllenprotein gp120 des HI-Virus. Durch eine Clathrin-vermittelte Endozytose gelangt das Virus in die Zelle, wo es seine virale RNA freisetzt. Diese wird mit Hilfe der Virus-eigenen Reversen Transkriptase in cDNA umgeschrieben, welche anschließend in das Wirtsgenom integriert wird. Mittels der Proteinbiosynthese-Maschinerie der Wirtszelle werden neue Viruspartikel hergestellt und neue Viren aufgebaut. Im letzten Schritt erfolgt dann die Freisetzung der neuen Viren.
Lentiviren in der Gentherapie – ein Anwendungsbeispiel
Die Wundheilung bei Diabetespatienten ist bekanntermaßen gestört und stellt nach wie vor eine Herausforderung bei der Behandlung diabetischer Wunden dar. Im Jahr 2005 erschien eine Publikation von Lee et al., in der gezeigt wurde, dass eine PDGF-B-Gentherapie mit Hilfe von Lentiviren zu einer verbesserten Wundheilung führt [4]. PDGF ist die Abkürzung für "platelet-derived growth factor". Es handelt sich hierbei um einen Wachstumsfaktor, der eine Mitose-stimulierende Wirkung auf Zellen hat. Thrombozyten bilden im Falle einer Verletzung PDGF, um die Wundheilung an der geschädigten Stelle zu initiieren. Auch an der Angiogenese und der Kollagen-Organisation im Bindegewebe ist PDGF beteiligt, was zum Aufbau von neuem und funktionstüchtigem Gewebe führt. Um diese Mechanismen in diabetischen Wunden zu fördern, und somit auch deren Heilung, wurde PDGF cDNA zusammen mit einem GFP-Reporter Protein-Tag in lentivirale Vektoren eingefügt. Zunächst wurden dermale Fibroblasten mit diesen Vektoren transfiziert, um die Produktion von PDGF mRNA nachzuweisen. Anschließend wurden die Vektoren zur Behandlung diabetischer Wunden in Mäusen getestet. Nach 21 Tagen war die Re-Epithelisierung im Vergleich zu unbehandelten Wunden als Kontrolle zwar gleich ausgeprägt, jedoch zeigten sich bei der Gruppe, welche eine PDGF-Gentherapie erhielt, eine signifikante Verbesserung der Neoangiogenese sowie wesentlich dickere, zusammenhängender ausgerichtete Kollagenfasern. Hieraus schlossen die Autoren, dass diese erfolgreiche, durch Lentiviren vermittelte Gentherapie vielversprechende Möglichkeiten für eine klinische Anwendung bietet.
Lentiviren als Vektoren
Lentiviren sind ein vielseitiges Werkzeug in der Forschung und Entwicklung. Mit ihrer Hilfe lassen sich gezielt Gensequenzen und stabil transfizierte Zelllinien erzeugen. Sie besitzen eine hohe Infektionsrate (>90%), bieten hohe Level an anschließender Proteinexpression und können sowohl in vitro als auch in vivo angewendet werden. Ein weiterer großer Vorteil, den Lentiviren von Natur aus mitbringen, ist ihre bereits erwähnte Fähigkeit, die Kernhülle ihrer Wirtszelle zu überwinden.
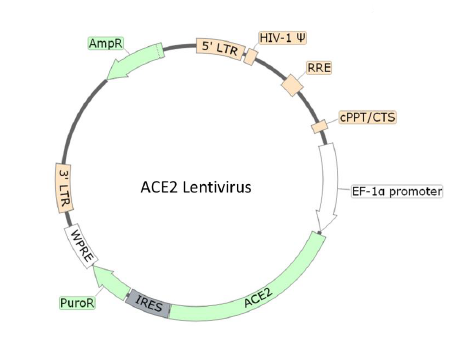
Lentivirus-Infektionssysteme werden häufig als sogenannte Pseudoviren angeboten. Ein Pseudovirus ist ein veränderter Lentivirus, bei dem das ursprüngliche Hüllenprotein ausgetauscht wird. Das für die Bindung an CD4-positve T-Helferzellen benötigte Hüllenprotein gp120 (s. Abb. 1) des HI-Virus kann zum Beispiel durch VSV G (vesicular stomatitis virus G protein) ersetzt werden. VSV G bindet an den menschlichen LDL-Rezeptor, wodurch eine Vielzahl an Zelltypen transfiziert werden kann - und nicht nur eine Zellart. Eine wichtige Neuentwicklung im Bereich der SARS-CoV-2-Forschung ist die Verfügbarkeit von Spike-Pseudoviren. Hier werden die Hüllenproteine durch funktionale Spike-Proteine ersetzt, welche ACE2-positive Zellen infizieren können. Die Spike-vermittelte Infektion aktiviert z.B. die Expression eines Reportergens, um eine quantitative Bestimmung der Spike/ACE2-Interaktion zu ermöglichen. So kann beispielsweise die Wirkung von therapeutischen Antikörpern oder anderen Substanzen analysiert werden. Solche Reportersysteme (z.B. eGFP oder Luciferase) sind auch für andere Pseudoviren erhältlich und erlauben eine leichte Analyse der Transfektion und der Produktion stabiler Zelllinien.
Generell gibt es unterschiedliche Vektor-Systeme, auf die man zurückgreifen kann. Man unterscheidet zwischen integrierenden und nicht-integrierenden Lentiviren-Vektoren. Integrierende Vektoren werden stabil in das Wirtsgenom eingebaut und an Tochterzellen weitergegeben, wohingegen nicht-integrierende Vektoren episomal (außerhalb des Genoms) verbleiben. Je nach Anwendung kann das eine oder das andere System von Vorteil sein. Lentiviren können auch zum Gen-Knock-Out (ko) oder Gen-Knock-In (ki) verwendet werden. Dazu wird ein CRISPR/Cas9-Lentivirus-System genutzt. Um Gene mit der CRISPR/Cas9-Methode an- oder auszuschalten, muss das Gen für das DNA-schneidende Enzym Cas9 zunächst in die Zielzellen eingebracht werden. Dazu werden die Zellen mit einem Cas9-Lentivirus-Vektor transfiziert. Anschließend können Cas9-positive Zellen zum Beispiel über eine Puromycin-Selektion identifiziert werden. Diese Zellen stehen nun für ko- oder ki-Experimente zur Verfügung [5]. Aufgrund ihrer hohen Transfektionsrate und ihrer Fähigkeit, durch Modifikationen der Virushülle sehr viele Zelltypen infizieren zu können, eignen sich Lentiviren besonders gut für diese Anwendung.
Sie interessieren sich für Lentiviren? Wir haben die passenden Produkte. Unser Lieferant BPS Bioscience hat ein großes Portfolio an Lentivirus-Infektionssystemen entwickelt.
Top 10 der meistverkauften Lentivirus-Produke
| Artikelnr. | Produktname |
| BPS-78215-1 | Spike (B.1.617.2 Variant) Pseudotyped Lentivirus (Luc Reporter) |
| BPS-78348-1 | Spike (B.1.1.529, Omicron Variant) (SARS-CoV-2) Pseudotyped Lentivirus (Luc Reporter) |
| BPS-79942-1 | Spike (SARS-CoV-2) Pseudotyped Lentivirus (Luc Reporter) |
| BPS-79833 | TEAD Luciferase Reporter Lentivirus |
| BPS-79692-P | Firefly Luciferase Lentivirus, PUROMYCIN |
| BPS-78028-1 | Spike (D614G) (SARS-CoV-2) Pseudotyped Lentivirus (Luc Reporter) |
| BPS-79982-1 | Spike (SARS-CoV-2) Pseudotyped Lentivirus (Luc-eGFP Dual Reporter) |
| BPS-79943 | Bald Lentiviral Pseudovirion (Luciferase Reporter) |
| BPS-78349-1 | Spike (B.1.1.529, Omicron Variant) (SARS-CoV-2) Pseudotyped Lentivirus (eGFP Reporter) |
| BPS-79578 | Negative Control Lentivirus (Firefly Luciferase) |
Um alle Lentivirus-Produkte von BPS Bioscience zu sehen, klicken Sie hier: Alle Lentivirus-Produkte
Für noch mehr Informationen zu Lentiviren und den passenden Produkten finden Sie auf unserer Homepage ein Webinar sowie eine Broschüre von BPS Bioscience.
Quellen:
[1] https://flexikon.doccheck.com/de/Lentivirinae
[2] Molecular biology and pathogenesis of animal lentivirus infections, Clements and Zink, Clinical Microbiology Reviews, Vol. 9, No. 1
[3] https://www.fz-juelich.de/SharedDocs/Pressemitteilungen/UK/DE/2017/2017-08-03-autophagie.html?nn=535780
[4] Lentiviral Transfection with the PDGF-B Gene Improves Diabetic Wound Healing
Lee et al., Plastic and Reconstructive Surgery: August 2005 - Volume 116 - Issue 2 - p 532-538
[5] Lentiviren Webinar BPS Biocscience https://www.biomol.com/resources/webinars/
Abb. 1: nach Jmarchn Own work, CC BY SA 3.0, https://commons.wikimedia.org/w/index.php?curid=58188472