Übersichtsartikel von Thomas G. Brock, Ph.D.
Wissenschaftler, die sich mit Autoimmunität oder rheumatoider Arthritis beschäftigen, wissen etwas, was vielen anderen häufig nicht bewusst ist: Die Citrullinierung von Proteinen ist extrem wichtig. Diese Form der posttranslationalen Modifikation erzeugt in ansonsten gewöhnlichen Proteinen neue Epitope (‘Neoantigene'), die sich als bedeutsam für Autoimmunerkrankungen erwiesen haben. Citrullinierung erfolgt sowohl extrazellulär als auch im Zellplasma und Zellkern, weswegen es so verschiedenartige Prozesse wie Blutgerinnung, Hautzelldifferenzierung und Chromatin-Remodelling beeinflussen kann. Auch wenn die Forschung in dieser Richtung erst am Anfang steht, ist seit neustem auch bekannt, dass Citrullinierung offenbar auch eine Rolle in der inflammatorischen Signalgebung besitzt. Am Ende dieses Artikels sollten Sie als Leser nicht nur ein Stück neue und spannende Wissenschaft gelernt haben, sondern vielleicht auch den Anstoß für innovative Ideen für Ihre zukünftigen Forschungsprojekte bekommen haben.
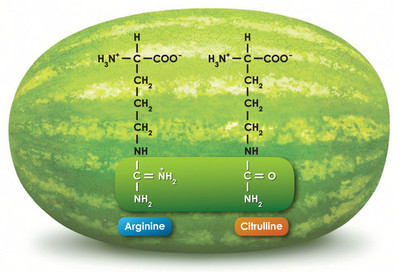
Citrullin und Wassermelonen
Biochemiker kennen Citrullin aus dem Harnstoffzyklus, einem wichtigen Prozess zur Ausscheidung von Ammoniak bei höheren Tieren. Citrullin ist eine α-Aminosäure mit hoher struktureller Ähnlichkeit zu Arginin. Im Harnstoffzyklus wird Carbamoylphosphat aus den Bausteinen Ammoniak, Hydrogencarbonat und Phosphat gebildet. Citrullin, welches durch die Ornithin-Transcarbamylase aus Carbamoylphosphat und Ornithin synthetisiert wird, ist lediglich ein Zwischenprodukt der Synthese von Arginin, das später durch Arginase 1 in Harnstoff und Ornithin gespalten wird. In diesem Zyklus wird Citrullin im Mitochondrium hergestellt und nach dem Export ins Zytoplasma verstoffwechselt.
Der Hobbygärtner unter Ihnen hat eventuell auch schon den formalen Namen Citrullus lanatus der allseits bekannten Wassermelone zugeordnet. Dieses Kürbisgewächs entstammt ursprünglich Süd- und Westafrika und wurde vor bereits 4000 Jahren im Niltal kultiviert. Wassermelonen, die heutzutage in allen ausreichend warmen Gebieten der Erde angebaut werden, sind außergewöhnlich reich an Arginin und Citrullin.1 Tatsächlich leitet sich der Name der Aminosäure Citrullin vom Gattungsnamen Citrullus der Wassermelone ab, aus deren Saft Citrullin 1914 erstmals isoliert wurde. Da Citrullin ein Vorläufer von Arginin ist und freies Arginin den vasoaktiven Mediator Stickstoffmonoxid freisetzen kann, sind die Wassermelonen nicht nur leckere sondern auch ausgesprochen gesunde Früchte.
Citrullinierung, PADs und Rheumatoide Arthritis
Citrullinierung ist die enzymatische Umwandlung von Arginin in Citrullin in situ im bestehenden Protein (Abbildung 2). Während dieser Reaktion katalysieren Deiminasen die Entfernung des Imins (doppelt gebundenen Stickstoffs) aus Arginin. Diese PAD (Peptidylarginin-Deiminasen) genannten Proteine kommen primär in Wirbeltieren, Bakterien und Pilzen vor. Bei Mensch, Ratte, Maus, Kuh, Pferd, Rhesus-Affe und Schimpanse gibt es jeweils fünf PAD Gene, die interessanterweise von 1-4 und 6 nummeriert wurden. Menschliche PAD-Gene kodieren jeweils ein Calcium-abhängiges Enzym mit eigenen Substraten und individueller Funktion. PAD3 wird beispielsweise in Haarfollikeln und Keratinozyten exprimiert, wo es Filaggrin des Follikels und Trichohyalin der inneren Wurzelscheide citrulliniert und so Haarfollikel- sowie epidermale Differenzierung reguliert. Filaggrin und Trichohyalin sind assoziiert zum Intermediärfilament und an der strukturellen Aggregation und Verbindung der Keratinfilamente beteilgt. Auch die Substrate manch anderer PADs sind Strukturproteine.2

Abbildung 2. PADs katalysieren die Ca2+-abhängige Reaktion eines Imins zu einer Ketogruppe an spezifischen Peptidylarginin-Seitenketten
Rheumatoide Arthritis (RA) ist schon lange als systemische Autoimmunerkrankung bekannt. Ein wichtiger Durchbruch gelang 1998 als Schellekens et al. feststellten, dass viele RA-Autoantikörper Citrullin in Peptiden erkennen, dass viele dieser Peptide spezifisch für RA sind und dass diese Antikörper bereits im Frühstadium der Erkrankung nachweisbar sind.3 Die Citrullinierung spezifischer Proteine wie Filaggrin, Vimentin, Fibrin, Fibrinogen, α-Enolase und Collagen II erzeugt neue Epitope, die zur Bildung von Autoantikörpern führen.4 Antikörper gegen citrullinierte Proteine (ACPAs) wurden somit als spezifische Biomarker für RA erkannt und ihr Assay-Nachweis erfolgt nun mit hoher Spezifität und Sensitivität unter Verwendung von CCP (Cyclic Citrullinated Peptide) als Capture-Antigen.5,6 Zusätzlich konnte gezeigt werden, dass der Anti-CCP-Antikörper Nachweis eine prädiktive Prognose für das Auftreten von erosiver Arthritis ermöglicht, was impliziert, dass Proteincitrullinierung eine ursächliche Rolle in der Entstehung von RA spielt und dass PAD Inhibitoren möglicherweise therapeutischen Nutzen besitzen.7
Das wichtigste Citrullinierungsenzym für die Entstehung von rheumatoider Arthritis ist PAD4, welches in neutrophilen und eosinophilen Granulozyten sowie Gewebe-lokalisierten Makrophagen aber nicht in zirkulierenden Monozyten exprimiert wird. Die normale Funktion von PAD4 liegt hierbei in der Regulation der Zelldifferenzierung und der Transkription von p53 und dem Östrogenrezeptor. Die pathogene Funktion äußert sich jedoch bei Gelenkentzündungen, die bei rheumatoider Arthritis durch Infiltration PAD4-positiver Leukozyten gekennzeichnet ist. Ein möglicher Mechanismus beruht auf einer Erhöhung der intrazellulären Calciumkonzentration im Rahmen der zellulären Aktivierung woraufhin PAD4 beginnt Vimentin zu citrullinieren, ein Intermediärfilament, welches an der Adhäsion, der Migration und dem Signalling der Leukozyten beteiligt ist. Alternativ könnte die großflächige Nekrose von Leukozyten im Gelenk in Folge der Degranulation zur Freisetzung von PAD4 sowie weiterer Proteine des Zytoskeletts in das calciumreiche entzündliche Milieu führen. Dort würde dies in einer deregulierten Citrullinierung diverser Proteine resultieren, doch auch hierbei verbleibt die Frage: "Warum passiert dies nicht bei anderen chronischen Entzündungen?"
Citrullinierung im Zellkern
Wie oben bereits erwähnt besitzt jedes der fünf PAD Enzyme eigene Substrate und zelluläre Funktionen (siehe Tabelle 1). Zum Beispiel: PAD1 und PAD3 sind zwar beide Epithel-assoziiert und tragen zur Differenzierung von Keratinozyten bei, doch PAD1s primäre Funktion liegt in der Aufrechterhaltung der kutanen Barriere, während PAD3 eine zentrale Rolle in der Entwicklung von Haarfollikeln spielt. PAD4 scheint als einziges PAD Enzym in der Lage zu sein effektiv in den Zellkern zu wandern, wodurch es in der Lage ist nukleäre Proteine wie die Histone H2A, H3 und H4 sowie die Histonacetyltransferase p300 zu citrullinieren. Die genaue Funktion von PAD4 und seine Implikationen für die Zellfunktion sind noch nicht zur Gänze verstanden, einige interessante Aspekte konnten jedoch schon aufgedeckt werden: Deiminierung und Methylierung von Argininseitenketten sind wohl wechselseitig abhängige Prozesse. PAD4 kann durch seine Demethyliminaseaktivität Monomethylgruppen von Arginin abspalten und somit den Effekt von Peptidylarginin-Methyltransferasen (PRMT) umkehren (Abbildung 3).8 PAD4 kann allerdings nicht dimethylierte Reste demethylieren, gleichzeitig können durch PAD4 deiminierte Seitenketten nicht mehr methyliert werden.9 PAD4 kann also einige der Effekte von PRMT blockieren oder gänzlich umkehren.

Abbildung 3. PADs demethylieren mono-methylierte Argininseitenketten. (A) PADs produzieren citrullinierte Seitenketten entweder aus normalem oder durch PRTMs mono-methyliertem Arginin. Aminotransferasen (AT) können citrullinierte Seitenketten zu iminierten Ketten umwandeln. (B) PRTMS und HATs dekondensieren Chromatin, während PADs und HDACs die Kondensation des Chromatin durch Citrullinierung des Methylarginins und Deacetylierung der Lysinseitenketten in den Histonarmen initiieren.
PAD4 ist außerdem an der Acetylierung/Deacetylierung von Proteinen beteiligt. Einige nukleäre Rezeptoren können erst dann ihre Funktion in der Transkriptionsregulierung ausüben, wenn sie neben ihrem Liganden auch den Coaktivator p160 gebunden haben, welcher wiederum die Histon-Acetytransferase p300 rekrutiert. Histonacetylierung ist ein notwendiger Schritt für Chromatin-Remodelling, Entfernung von Histonen oder transkriptionelle Coaktivierung. Die Bindung von p300 zum Coaktivator p300 wird durch die Methylierung von p300 Arg2142 durch CARM1 (PRMT4) verhindert, diese Methylierung kann aber durch PAD4 entfernt werden. PAD4 wirkt somit aktiv verstärkend auf die p160-p300 Bindung und damit auf die Transkription. Zudem assoziiert PAD4 direkt mit der Histon-Deacetylase 1 (HDAC1) und bildet hierdurch einen spezifischen Proteinkomplex der die Aktivitäten und Funktionen beider Proteine in sich vereint.10 Der PAD4-HDAC-Komplex bindet periodisch an dem zyklisch durch den Östrogen-Rezeptor alpha (ERα) aktivierten pS2-Promotor und bewirkt in der Folge ein zur Bindung korrespondieres Ab- und Zunehmen der Acetylierung und Citrullinierung von H3. Die Assoziation von PAD4 und HDAC1 an pS2 führt zu einer reversiblen, repressiven Chromatinumgebung.11,12
|
Tabelle 1. PAD Enzyme, ihre Substrate und Lokalisation in Zellen und Geweben |
||
| Enzym | Substrate | Vorkommen |
| PAD1 | Keratin K1, Filaggrin | Epidermis, Uterus, Keratinozyten |
| PAD2 | Vimentin, Basisches Myelinprotein, Saures Gliafaserprotein | Skelettmuskel, Gehirn, Pankreas, Gliazellen, Makrophagen, Knochenmark, Brustgewebe, Darm, Embryo, Auge, Niere, Epidermis, Uterus, Thymus |
| PAD3 | Trichohyalin, Filaggrin | Haarfollikel, Keratinozyten |
| PAD4 | H2A, H3, H4, Vimentin, Nukleophosmin, p300, PAD4, 40S RPS2, Antithrombin | Eosinophile und Neutrophile Granulozyten |
| PAD5 | unbekannt | Ovum, Ovar, früher Embryo, Thymus, Oozyte |
Krebs und NETs
Das Tumorsuppressorprotein p53 reguliert die Expression diverser Zielgene, die wiederum Zellwachstum und Apoptose modulieren. PAD4 und HDAC interagieren über bestimmte Proteindomänen mit p53 und kolokalisieren somit mit p53 regulierten Promotoren.13,14 Der PAD4 Inhibitor Cl-Amidin und der HDAC Inhibitor SAHA können daher additiv die Expression entsprechender Gene induzieren. PAD4s Funktion als Corepressor für p53 ist ein möglicher Ansatz um PAD4s Rolle bei Tumorerkrankungen zu erklären: Die Deiminase PAD4 ist nämlich in vielen Brust-, Lungen, Leber-, Speiseröhren-, Darm-, Nieren-, Ovarial-, Endometrial-, Uterus- und Blasenkarzinomen überexprimiert.15 Die PAD4 Inhibitoren F- und Cl-Amidin zeigen zudem zytotoxische Wirkung gegen Tumorzelllinien aber nicht gegen gewöhnliche Zelllinien.16 Diese Daten suggerieren, dass PAD4 Inhibitoren nicht nur bei der Behandlung von RA nützlich wären sondern auch bei der Krebstherapie.
Auf der anderen Seite ist die Citrullinierung durch PAD4 auch an der Immunantwort gegen Bakterien beteiligt. Neben ihrer schweren Bewaffnung in Form ihrer Granula können neutrophile Granulozyten auch auf sogenannte NETs zurückgreifen. NETs (Neutrophil Extracellular Traps) bestehen aus hochgradig dekondensiertem Chromatin, mit dem Bakterien gefangen und abgetötet werden.17 Einschränkungen in der NET Formierung, die im Normalfall durch die unkontrollierte Hypercitrullinierung von Histonen ausgelöst werden, sind ein entscheidender Risikofaktor für bakterielle Infektionen. PAD4 defiziente neutrophile Granulozyten sind folglich nicht in der Lage NETs zu bilden und PAD4-/--Mäuse sind empfindlicher gegenüber bakteriellen Infektionen als PAD4+/+-Mäuse.19 Dies bedeutet, dass die systemische Einnahme von PAD4 Inhibitoren die Immunantwort gegen Infektionen beeinträchtigen würde.
Referenzen
- Tedesco, T.A., Benford, S.A., Foster, R.C., et al. Pediatrics 73(6), 879 (1984).
- Jones, J.E., Causey, C.P., Knuckley, B., et al. Curr. Opin. Drug Discov. Devel. 12(5), 616-627 (2009).
- Schellekens, G.A., de Jong, B.A., van den Hoogen, F.H., et al. J. Clin. Invest. 101(1), 274-281 (1998).
- Conrad, K., Roggenbuck, D., Reinhold, D., et al. Autoimmun. Rev. 9(6), 431-435 (2010).
- Schellekens, G.A., Visser, H., deJong, B.A., et al. Arthritis Rheum. 43(1), 155-163 (2000).
- Wiik, A.S., van Venrooij, W.J., and Pruijn, G.J.M. Autoimmun. Rev. 10(2), 90-93 (2010).
- Duskin, A. and Eisenberg, R.A. Immunol. Rev. 233(1), 112-125 (2010).
- Wang, Y., Wysocka, J., Sayegh, J., et al. Science 306(5694), 278-283 (2004).
- Cuthbert, G.L., Daujat, S., Snowden, A.W., et al. Cell 118(5), 545-553 (2004).
- Lee, Y.-H., Coonrod, S.A., Kraus, W.L., et al. Proc. Natl. Acad. Sci. USA 102(10), 3611-3616 (2005).
- Denis, H., Deplus, R., Putmans, P., et al. Mol. Cell Biol. 29(18), 4982-4993 (2009).
- Métivier, R., Penot, G., Hübner, M.R., et al. Cell 115(6), 751-763 (2003).
- Li, P., Yao, H., Li, M., et al. Mol. Cell Biol. 28(15), 4745-4758 (2008).
- Li, P., Wang, D., Yao, H., et al. Oncogene 29(21), 3153-3162 (2010).
- Chang, X., Han, J., Pang.L, et al. [In Press] BMC Cancer (2009).
- Slack, J.L., Jones, L.E., Jr., Bhatia, M.M., et al. Biochemistry 50(19), 3997-4010 (2011).
- Brinkmann, V., Reichard, U., Goosmann, C., et al. Science 303(5663), 1532-1535 (2004).
- Wang, Y., Li, M., Stadler, S., et al. J. Cell Biol. 184(2), 205-213 (2009).
- Li, P., Li, M., Lindberg, M.R., et al. J. Exp. Med. 207, 1853-1862 (2010).